脑智卓越中心开发出特异性更高、安全性更好的高保真版Cas13系统
文章来源:脑科学与智能技术卓越创新中心 | 发布时间:2022-08-10 | 【打印】 【关闭】
CRISPR-Cas13是一类由RNA介导的靶向RNA的基因编辑技术。Cas13蛋白属于2类VI型多结构域单一蛋白RNA内切酶,许多体外研究表明Cas13蛋白激活后不仅具有切割靶RNA的功能,还能对其周围的任意RNA(bystander RNA)进行非特异性地切割,这一特性也被用于开发RNA检测。自2015年报道Cas13a(c2c2)以来,国内外报道了一批CRISPR-Cas13系统(Cas13b/c/d/X/Y/bt),并证明了其可以在哺乳动物细胞中对靶RNA进行高效且特异性地敲低。相较于Cas9介导的DNA编辑技术,基于Cas13的RNA编辑工具靶向动态转录的RNA,不会对基因组造成永久性改变,而且可以通过剂量调整等方式控制RNA编辑效果,具有可逆性,相对来说更安全。
然而,越来越多的证据表明Cas13a、Cas13b、Cas13d等在哺乳动物细胞中普遍存在着旁切活性(collateral activity),会造成严重的脱靶效应。最新的研究也表明Cas13(特别是Cas13d)对动物细胞和个体产生都会造成很大的毒副作用。所以,Cas13蛋白本身普遍存在的旁切活性已成为其走向临床应用的最大障碍,如何降低或消除Cas13蛋白的旁切活性显得尤为必要,开发更特异的高保真Cas13蛋白对基于RNA编辑的基因治疗策略研发及后续的临床转化具有重要意义。
2022年8月11日,《Nature Biotechnology》期刊在线发表了题为“High-fidelity Cas13 variants for targeted RNA degradation with minimal collateral effects”的研究论文,该研究由中国科学院脑科学与智能技术卓越创新中心(神经科学研究所)、神经科学国家重点实验室、中国科学院灵长类神经生物学重点实验室、上海脑科学与类脑研究中心杨辉研究组和辉大(上海)生物科技有限公司研发团队合作完成。该研究综合利用蛋白质工程、流式细胞术、体外切割实验、全转录组测序、转基因小鼠、在体基因治疗安全性验证等技术手段,对Cas13(包括Cas13d和Cas13X)进行蛋白工程化改造、筛选及验证,开发出了具有高效编辑活性但极低旁切活性的高保真Cas13蛋白变体。本研究对基于RNA编辑的基础科学研究、基因治疗策略研发以及后续的临床转化具有重要意义。
研究人员开发了基于绿色荧光蛋白(EGFP)和红色荧光蛋白(mCherry)的双荧光报告系统,用于在哺乳动物细胞中检测Cas13蛋白的旁切效应。通过靶向敲低一种荧光蛋白(如mCherry)的mRNA,检测另外一种荧光蛋白(如EGFP)的表达水平,研究人员发现Cas13a与Cas13d蛋白的激活都能诱导出非常显著的旁切效应。为了降低或消除Cas13d蛋白的旁切活性,研究人员预测并对比分析了Cas13d的蛋白结构。目前已报道的Cas13家族成员均带有2个标志性的HEPN结构域,其上的RxxxxH保守基序是Cas13核酸酶催化活性位点。当Cas13蛋白与gRNA结合其核酸酶活性被激活后,该催化活性位点会暴露在蛋白表面,继而对周围的RNA进行无差别的切割。
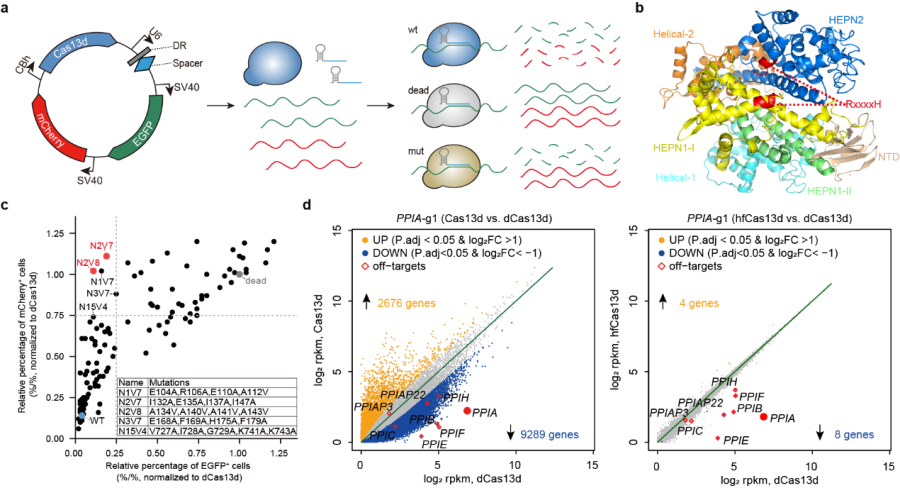
图1:高保真Cas13蛋白的工程化设计、筛选及脱靶效应验证
研究人员利用蛋白质工程手段对Cas13d蛋白进行一系列的突变改造,以改变Cas13d蛋白与非靶RNA的相互作用,并综合利用哺乳动物细胞转染、流式细胞术等方法,筛选获得了一些具有高效编辑活性但旁切活性显著降低的Cas13d蛋白变体,其中Cas13d-N2V8变体综合表现出最好的特异性,具有最高保真性(high-fidelity Cas13d,hfCas13d)。通过对大量内源基因位点进行RNA敲低的实验,hfCas13d表现出与野生型Cas13d同样的高活性。结合体外切割实验、全转录组分析、稳转细胞系、转基因小鼠、在体靶向RNA敲降等技术,对hfCas13d进行了系统性的脱靶效应验证及安全评估。综合而言,此项工作开发出了具有高效编辑活性但极低旁切活性的高保真Cas13d蛋白变体,这一新工具显示出更高特异性,而且在基因治疗方面具有更好的安全性。
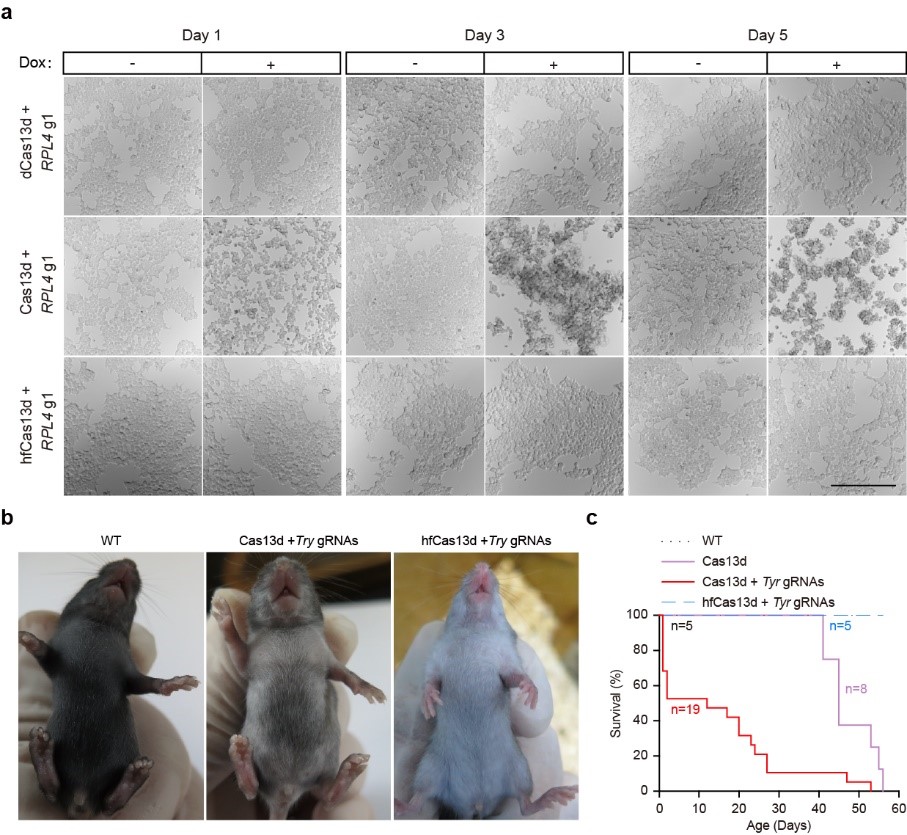
图2:高保真Cas13蛋白在哺乳动物细胞及个体中有效性及安全性的评估
值得一提的是,2021年,杨辉研究组在《Nature Methods》上报道了目前最小的RNA编辑工具Cas13X系统(仅775个氨基酸),本项工作在此基础上进一步开发出了具有高效编辑活性但极低旁切活性的高保真Cas13X蛋白变体(hfCas13X),其将在基于RNA编辑的基因治疗领域显示出非常大的应用潜力。
中科院脑智卓越中心博士研究生黄佳、肖庆全,博士后贺冰冰、董雪,刘元花副研究员和辉大(上海)生物科技有限公司技术开发部童华威博士为共同第一作者,杨辉研究组的博士后汪子康、硕士研究生韩鼎毅和博士研究生王旭晨等成员积极参与课题做出了重要贡献。本工作获得国家基金委、科技部、上海市、中科院和临港实验室的资助。
