单链抗体(single chain variable fragment, scFv)由抗体的重链和轻链可变区通过一段柔性多肽连接而成。scFv分子量仅约30 kDa,具有较高的组织穿透能力,在体内比抗体更快被清除。scFv可避免由Fc区介导的免疫反应。这些特征使scFv更适合应用在体内影像诊断、肿瘤和细胞内病原体的靶向治疗等领域。
然而由于固有的低溶解度和稳定性,只有两种大肠杆菌生产的scFv已被批准用于治疗。因此,迫切需要相关手段提高大肠杆菌表达的scFv溶解度和稳定性,为scFv的生产、研究和应用提供理论基础。
近日,中科院上海药物研究所新药研究国家重点实验室罗成课题组陈示洁副研究员与复旦大学基础医学院分子病毒学教育部/卫健委/医科院重点实验室王勇翔副研究员组成联合团队,在大肠杆菌表达的单链抗体溶解度和稳定性领域取得重要进展,相关成果“A 33-residue peptide tag increases solubility and stability of Escherichia coli produced single-chain antibody fragments”于2022年8月8日在线发表于 Nature Communications杂志上。
scFv的重链和轻链可变区的链内二硫键对于其稳定性至关重要。普通大肠杆菌细胞浆不仅缺少催化二硫键形成的组分还具有谷胱甘肽还原酶和硫氧还蛋白还原酶还原二硫键,因此绝大多数在普通大肠杆菌细胞浆表达的scFv都呈不溶性的包涵体。一些具有促溶活性的蛋白标签如MBP、GST、NusA和Trx等能够进一步提高它们的溶解度。但是,如MBP之类的促溶标签蛋白因体积庞大而形成空间位阻干扰scFv与抗原结合,因此必需通过蛋白酶切去除;而去除了促溶标签蛋白又会使scFv不稳定,诱导产生无活性的聚集体。
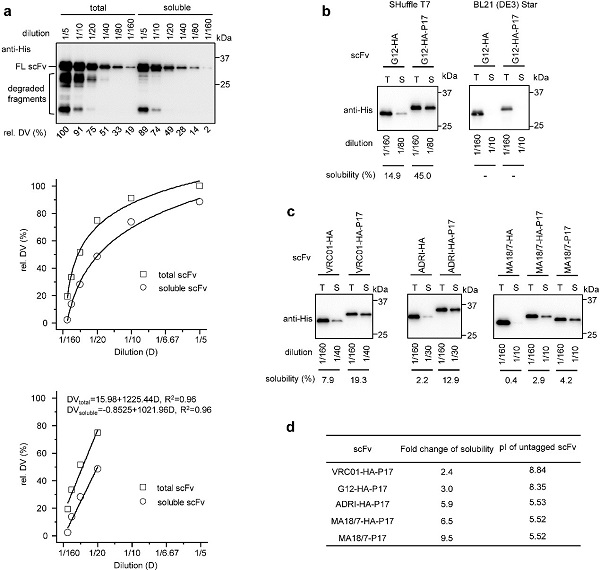
图1.P17标签提高了4种scFv在大肠杆菌SHuffle菌株中的溶解度。
来自T7噬菌体尾部的P17蛋白通过一段由33个氨基酸组成的多肽(称作P17多肽或标签)与肝细胞表面的低密度脂蛋白受体相关蛋白(LRP)特异性结合将噬菌体颗粒和小分子、蛋白、核酸以及脂质体等靶向运送到肝细胞。研究人员选择能够靶向乙肝病毒包膜蛋白的G12-scFv作为研究对象,为了提高G12-scFv被肝细胞内吞的效率,将P17标签融合在其羧基末端。在大肠杆菌SHuffle菌株表达时,G12-scFv-P17蛋白的溶解度显著高于G12-scFv蛋白。通过半定量溶解度测定实验研究人员发现P17标签还能有效地提高其它3种不同scFv在SHuffle菌株中的溶解度,且P17标签对scFv的促溶效应与它在氨基和羧基末端的位置无关。通过缺失突变和点突变分析发现P17标签对scFv的促溶效应与它的亲水序列尤其是带电氨基酸残基相关,而与可能存在的α螺旋二级结构无关。
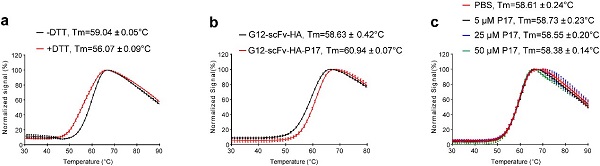
图2.P17标签提高了G12-scFv的热稳定性。
通过热稳定性实验,研究团队发现P17标签和链内二硫键一样提高scFv的热稳定性。而且P17标签融合的G12-scFv与抗原的结合能力以及它的病毒中和活性提高了超过两倍,这些数据提示P17标签具有I型分子内伴侣样的活性。综上,该研究发现33肽标签能够显著提高单链抗体在大肠杆菌Shuffle细胞中的溶解度和稳定性,为单链抗体的生产、研究和应用提供理论基础。
该论文的通讯作者为复旦大学王勇翔副研究员和上海药物所罗成课题组陈示洁副研究员,第一作者为复旦大学硕士毕业生王阳和袁雯婕以及上海药物所/南昌大学联合培养博士生郭思岐。该研究还得到了复旦大学闻玉梅院士、袁正宏研究员、童舒平教授、陈振国研究员、上海药物所罗成研究员和德国弗赖堡大学Michael Nassal教授等的支持和帮助。该工作得到了国家自然科学基金和上海市科委项目等的资助。