欧阳波组揭示胆固醇调控PD-L1稳定性的分子机制
文章来源:分子细胞科学卓越创新中心 | 发布时间:2022-08-29 | 【打印】 【关闭】
8月26日,国际学术期刊Science Advances在线发表了中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)欧阳波研究组的研究成果“Regulation of PD-L1 through direct binding of cholesterol to CRAC motifs”。该研究发现胆固醇分子可以直接与PD-L1跨膜段的两个CRAC基序结合,形成类似于“三明治”样的结构,来调控细胞膜上PD-L1的稳定性和降解。
胆固醇是人体细胞膜的主要成分之一,可以调节细胞膜的流动性和通透性。胆固醇也是体内合成类固醇激素的重要原料。正常情况下细胞中的胆固醇水平在多个不同层次受到严格调控,以维持身体正常生理功能。而肿瘤细胞中胆固醇水平往往比较高,胆固醇代谢异常活跃,以满足肿瘤细胞快速增殖、侵袭以及转移的需求。
近年来许多研究表明,胆固醇可以通过直接与膜蛋白结合,参与调控许多膜蛋白的结构和功能,并鉴定出了多个胆固醇结合的基序。PD-L1是肿瘤细胞中高表达的配体分子,与T细胞中的PD-1抑制受体结合后,能够抑制T细胞功能,达到肿瘤免疫逃逸。蛋白序列分析表明人源PD-L1的跨膜区域包含了两个经典的CRAC胆固醇结合基序。那么,肿瘤细胞中高水平的胆固醇和高表达的PD-L1之间是否存在直接联系呢,胆固醇是否对PD-L1起调控作用呢?
为验证这一猜想,研究者们首先通过生化和细胞功能实验证明了胆固醇可以稳定细胞膜上的PD-L1,降胆固醇药物辛伐他汀和胆固醇清除剂甲基β环糊精的加入都会降低细胞膜上PD-L1的水平,增强PD-L1的降解。然后,他们解析了PD-L1跨膜和胞内段(PD-L1-TC)的结构,利用核磁滴定鉴定了PD-L1-TC与胆固醇结合的位点,发现胆固醇可以直接结合在PD-L1跨膜段的两个CRAC基序上。分子动态模拟进一步确认了PD-L1-TC可以稳定地与两分子胆固醇结合。功能实验表明,去除胆固醇和突变胆固醇的结合位点都会导致PD-L1更容易降解,细胞中PD-L1的水平下降。该发现提出了一个新的调控PD-L1稳定性的分子机制,为以PD-L1为靶点的相关肿瘤免疫疗法提供了新思路。
分子细胞卓越中心王倩博士生和曹云雷硕士(现上海交大博士研究生)为本文的共同第一作者。分子细胞卓越中心欧阳波研究员和温茂荣副研究员以及天津医科大学王树青副教授为该论文的共同通讯作者。该研究得到了科技部资助项目、中国科学院和国家自然科学基金等经费资助。感谢张江实验室国家蛋白质科学研究(上海)设施核磁系统吴斌和显微镜成像系统于洋的大力协助。
文章链接: https://www.science.org/doi/10.1126/sciadv.abq4722
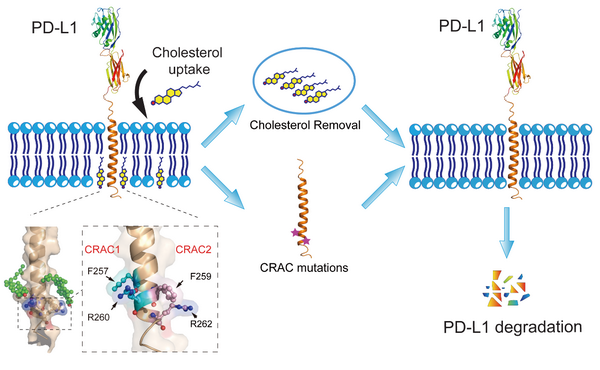
胆固醇调控PD-L1稳定性和降解的示意图
