近年来,在许多生命代谢过程中都观察到了蛋白质相分离的现象,核酸分子被发现广泛参与了调控蛋白质相分离和动态凝聚过程以及生理功能。其中,涉及RNA解旋酶的相分离现象及其相应的体内功能已被深入报道。例如,DEAD-Box家族中的众多RNA解旋酶通过相分离在mRNA翻译、RNP组成以及RNA最终命运等代谢过程发挥着关键作用。但是,与DNA解旋酶相关的相分离研究却十分有限。此外,由于技术上的限制,直接可视化和表征核酸分子与蛋白质在相分离状态下的相互作用仍然非常具有挑战性。对于蛋白质如何调节共凝聚体中的核酸结构与性质目前还知之甚少。
近日,中科院上海有机化学研究所交叉中心刘聪课题组与上海科技大学生命科学与技术学院孙博课题组合作在学术期刊《德国应用化学》(Angewandte Chemie International Edition)上在线发表了题为“Bloom syndrome helicase compresses single-stranded DNA into phase-separated condensates”(布鲁姆解旋酶通过相分离压缩单链DNA形成共凝聚体)的研究论文。研究人员利用荧光光镊技术,在单分子水平发现布鲁姆解旋酶(Bloom syndrome helicase,BLM)与单链DNA(single-stranded DNA,ssDNA)通过相分离形成蛋白-核酸共聚体的互作新模式。
BLM是RecQ家族中一种重要的DNA解旋酶,广泛参与了维持基因组的完整性和稳定性的代谢过程。BLM的功能缺失、突变可导致一种罕见的常染色体隐性遗传病,即布鲁姆综合征,具有显着的遗传不稳定性。更重要的是,在多种癌症组织中,如乳腺癌和淋巴瘤等,均发现了高表达的BLM蛋白。BLM的过表达同样被认为与基因组不稳定性密切相关。然而,与BLM过表达相关的基因组不稳定和癌症发病率增加的分子机制仍在很大程度上未知。
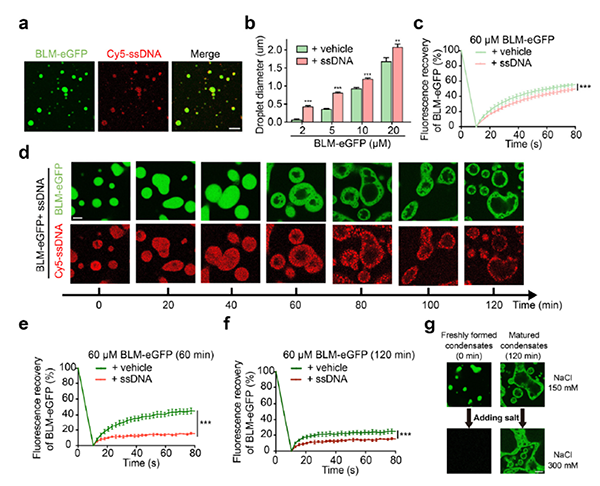
本工作中,研究人员利用荧光光镊技术,在单分子水平上发现了高浓度的BLM蛋白可以在解旋双链DNA(double-stranded DNA,dsDNA)后压缩新生成的ssDNA并形成凝聚体。进一步研究表明BLM本身具有很强的相分离能力,形成的蛋白凝聚体会经历快速的液-固相相转变形成凝胶态,而ssDNA能够与BLM共分相并加速共凝聚体向胶态的转变 (图1)。
图1 ssDNA促进BLM相分离并形成动态阻滞的BLM/ssDNA共凝聚体
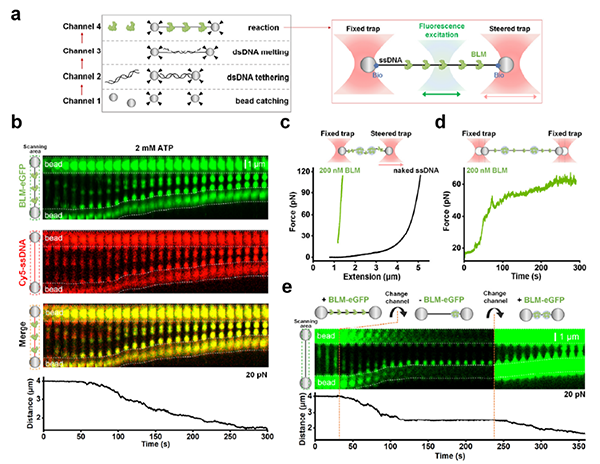
研究人员通过荧光光镊技术发现,BLM能够与ssDNA共凝聚并导致ssDNA的压缩,其在ATP水解的驱动下,可以抵抗数十皮牛的阻力(图2)。此外,BLM还能够通过移除与ssDNA结合的RPA或RAD51蛋白来压缩ssDNA,这也为BLM作为抗重组酶,参与同源重组修复过程中的抗重组功能提供了新的证据。进一步研究表明,单链DNA促进了动态阻滞的BLM凝聚体的形成,导致其可逆性明显降低。
图2 ATP水解帮助BLM抵抗外力与ssDNA的共凝聚
综上,本工作展示了DNA解旋酶BLM具有很强的相分离能力,并且其凝聚过程受ssDNA的动态调控,在单分子水平上展示了BLM与ssDNA共凝聚过程中的抗阻力特性和低可逆性。同时,该工作也为BLM过表达导致基因组不稳定的分子机制及其在同源重组中的抗重组功能提供了新的见解。
该论文中,孙博课题组2019级博士生王滕及刘聪课题组2020级博士生胡姣姣为共同第一作者,孙博教授与刘聪研究员为共同通讯作者。该工作得到了科技部、国自然基金委及上海市科委等基金的支持。