Mol Cell | 上海药物所合作发现细胞能量感受器AMPKγ全新作用机制
文章来源:上海药物研究所 | 发布时间:2022-11-17 | 【打印】 【关闭】
AMPK是细胞内重要的生物能量代谢调节分子。AMPK能够感受细胞内ATP/AMP/ADP水平,在低能量供给条件下,磷酸化下游特异性底物,减少ATP的消耗,促进ATP的合成。AMPK由催化亚基AMPKα、支架蛋白AMPKβ和调节亚基AMPKγ组成。AMPKγ的CBS结构域能够结合ATP、AMP、ADP,并根据其比例不同而改变构象,从而调节AMPKα活性。
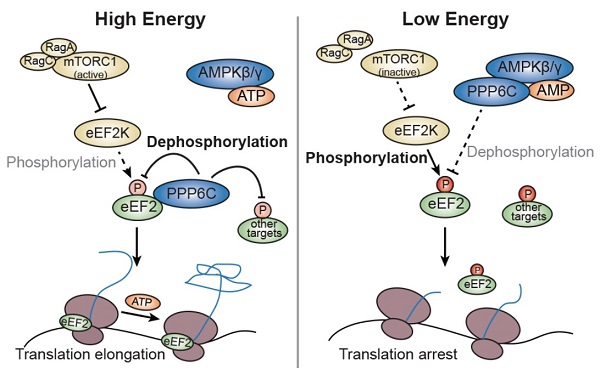
2022年11月15日,浙江大学生命科学研究院赵斌教授团队和冯新华教授团队、中国科学院上海药物研究所谭敏佳研究员团队合作在Molecular Cell上在线发表题为Energy sensor AMPK gamma regulates translation via phosphatase PPP6C independent of AMPK alpha 的研究论文。这一研究通过比较AMPKγ和AMPKα敲除细胞中底物磷酸化水平、采用串联亲和纯化以及磷酸化蛋白质组学分析等方法,揭示了AMPKγ可独立于经典的催化亚基AMPKα,调控磷酸酶PPP6C,进而调节其下游底物(例如eEF2)的磷酸化,从而介导了细胞能量水平对蛋白质合成的调控。
该研究通过对比葡萄糖饥饿处理后AMPKγ和AMPKα敲除细胞内经典下游底物的磷酸化水平差异,发现被认为间接受AMPKα激酶调控的eEF2蛋白的磷酸化在AMPKγ敲除后下降,但在AMPKα敲除后反而上升。进一步研究表明,AMPKγ能够参与调控eEF2的去磷酸化。通过AMPKγ互作蛋白质谱鉴定以及磷酸酶文库筛选,发现PPP6C的敲减明显导致eEF2磷酸化上升,并且能被葡萄糖饥饿调控。体外和体内结果显示,能量水平可以调控AMPKγ和PPP6C的结合,进而调控PPP6C与eEF2的结合。结果表明AMPKγ能够独立于AMPKα,与PPP6C形成复合物,感受能量变化,调控蛋白的去磷酸化。结合细胞内稳定同位素标记培养技术(SILAC)的定量磷酸化修饰组学策略对野生型和PPP6C敲低细胞在能量应激状态下磷酸化修饰组进行定量分析显示,除eEF2外,还有多个磷酸化位点被相似的机制调控。进一步验证表明,葡萄糖饥饿同样可以通过AMPKγ-PPP6C调控HSPB1(S82)和PCM1(S93)的磷酸化。
综上,该研究第一次提出AMPKγ可以独立于AMPKα,与其他效应分子(如PPP6C),参与能量平衡的调控。AMPKγ-PPP6C调控的蛋白质去磷酸化可能在能量应激失调相关疾病中也发挥重要作用。
浙江大学生命科学研究院赵斌课题组周琦、中国科学院上海药物研究所谭敏佳课题组郝兵兵为本文的共同第一作者。赵斌教授、谭敏佳研究员和冯新华教授为共同通讯作者。该工作还得到了陈帅、叶存奇等合作实验室的大力支持。
细胞能量水平通过AMPKγ-PPP6C调控蛋白质合成模式图