黄朝锋研究组揭示抗铝毒转录因子STOP1上游铝毒信号转导机制
文章来源:分子植物科学卓越创新中心 | 发布时间:2022-11-24 | 【打印】 【关闭】
2022年11月22日,国际学术期刊Molecular Plant在线发表了中国科学院分子植物科学卓越创新中心黄朝锋研究组题为“The MEKK1-MKK1/2-MPK4 cascade phosphorylates and stabilizes STOP1 to confer aluminum resistance in Arabidopsis”的研究论文。该研究揭示了MEKK1-MKK1/2-MPK4蛋白激酶级联途径正调控STOP1磷酸化和稳定性从而调控植物抗铝毒的新机制。
酸性土壤约占世界耕地面积的30%,并且随着频繁的耕作和氮肥的过度施用耕地土壤正在进一步酸化。铝毒是作物在酸性土壤生产的主要限制因子,也是仅次于干旱的第二大非生物逆境。STOP1/ART1是植物中保守的、核心的抗铝毒转录因子。该研究组之前的研究结果表明,STOP1蛋白受到泛素化和SUMO化修饰调控(Zhang et al. 2019. PNAS;Fang et al. 2020. Plant Cell;Fang et al. 2021. Plant Journal;Fang et al. 2021. Plant Signal Behav);STOP1 mRNA的输送受到THO/TREX复合物组分HPR1和TEX1的调控(Guo et al. 2020. New Phytologist;Zhu et al. 2021. Front Plant Sci)。但是,铝毒如何在转录后水平正调控STOP1蛋白积累仍不清楚。
该研究利用受STOP1调控的pAtALMT1:LUC报告基因系进行正向遗传筛选,鉴定了一个使报告基因表达升高的显性突变体rae4;该rae4突变导致STOP1蛋白含量升高,从而更抗铝毒。基因克隆发现,RAE4即为STOP1;rae4中STOP1蛋白上的第387位脯氨酸(P)突变成了丝氨酸(S)。进一步的氨基酸替换遗传互补实验以及之后的酵母双杂交实验揭示,这个P387S突变可能导致S387被磷酸化,抑制STOP1与F-box蛋白RAE1的互作,从而增强了STOP1蛋白的稳定性。
P387的前一位氨基酸为苏氨酸(T386)。由于TP或SP为MAPK激酶的识别基序,因此该研究推测MAPK激酶可能介导了T386的磷酸化。通过一系列的生化、遗传实验,证明了铝毒能够增强MPK4激酶活性,而MPK4与STOP1直接互作介导其磷酸化,增强STOP1的稳定性。STOP1蛋白上存在三个MPK4识别基序:T386P, S448P, S486P;这三个氨基酸TSS的磷酸化能够抑制STOP1与降解因子RAE1的互作,从而增强STOP1的稳定性和和植物的抗铝毒能力。
进一步研究发现,MPK上游的MEKK1和MKK1/2也正调控STOP1的磷酸化和稳定性。因此,该研究揭示了铝毒通过激活MEKK1-MKK1/2-MPK4级联通路磷酸化STOP1,从而抑制STOP1与RAE1的互作,增强STOP1蛋白稳定性和植物抗铝毒能力的新机制。此外,鉴于STOP1抗铝毒的保守性和重要性,该研究也为通过改变STOP1磷酸化状态提高作物抗铝毒能力提供新思路、新途径。
博士毕业生周芳林为论文的第一作者,黄朝锋研究员是该论文的通讯作者。该研究受到了国家自然科学基因面上项目和植物分子遗传国家重点实验室的资助。
原文链接: https://www.cell.com/molecular-plant/fulltext/S1674-2052(22)00410-5
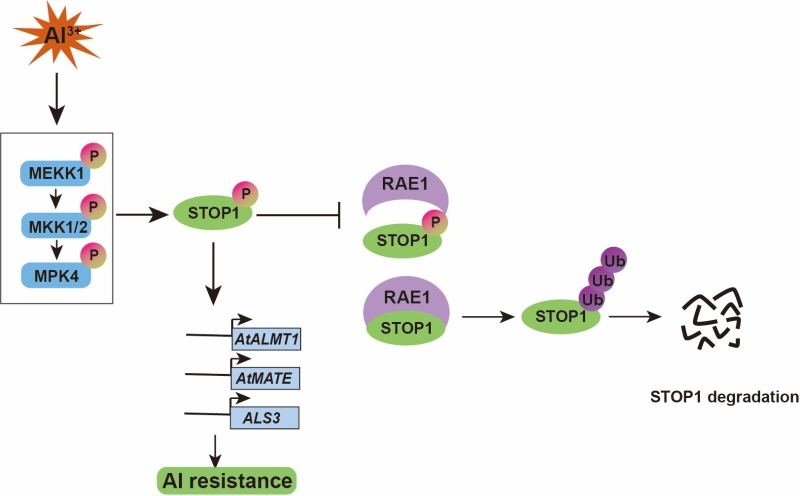
铝毒通过激活MEKK1-MKK1/2-MPK4级联通路促进STOP1的磷酸化;该磷酸化抑制STOP1与F-box蛋白RAE1的互作,从而增强STOP1蛋白稳定性和植物的抗铝毒能力。
