分子细胞卓越中心合作发展针对柯萨奇病毒A16型的中和抗体并揭示其分子机制
文章来源:分子细胞科学卓越创新中心 | 发布时间:2023-01-05 | 【打印】 【关闭】
12月21日,国际学术期刊Nature Communications在线发表了中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)丛尧研究组与中国科学院上海巴斯德研究所黄忠研究组的合作研究论文“Molecular mechanism of antibody neutralization of coxsackievirus A16”。该研究开发了两个针对柯萨奇病毒A16型(CVA16)的特异性单克隆抗体9B5和8C4,基于冷冻电镜及生化分析,阐明了上述特异性抗体所介导的中和保护的功能和结构基础,为设计和开发CVA16疫苗和抗体疗法提供了重要信息。
CVA16是小核糖核酸病毒科肠道病毒属成员,是婴幼儿手足口病(HFMD)的主要病原体之一。CVA16感染可导致轻微和自限性症状,以及严重的临床并发症,如脑炎、心肌炎、肺炎,甚至死亡。然而,目前尚无疫苗和治疗药物。中和抗体在抗病毒保护免疫中起着关键作用。因此,开发CVA16特异性中和抗体并确定其功能、结合表位和工作机制非常重要,有助于抗CVA16疫苗和药物的开发。
黄忠团队制备了两个CVA16特异性的单克隆抗体9B5和8C4。上述抗体不但具有强的体外中和活性,而且在CVA16小鼠感染模型中显示出有效的预防和治疗效果(图a,b)。生化研究表明,两个抗体具有不同的中和机制:9B5通过阻断CVA16与吸附受体硫酸肝素的结合从而抑制病毒吸附到细胞表面;而8C4在病毒吸附后的阶段发挥作用,阻碍病毒和脱衣壳受体SCARB2的结合(图c)。 丛尧团队解析了CVA16病毒颗粒分别结合抗体9B5及8C4所形成复合体的冷冻电镜结构。两个体系均获得了三个不同的构象,命名为C1, C2, C3(图d-o), 其中CVA16-9B5-C1 和CVA16-8C4-C2的分辨率均达到2.9埃。C1中的CVA16呈现成熟病毒构象(图d, g, j, m);C2中的CVA16为紧凑空壳构象,无病毒RNA(图e, h, k, n);C3中的CVA16为膨胀空壳构象,显示出明显的构象差异,包括衣壳的膨胀、二次轴孔洞的打开、病毒RNA缺失(图f, i, l, o)。结构分析表明9B5结合在CVA16的五重轴上,每个单体结合一个9B5 Fab(图d)。9B5与CVA16峡谷区(canyon)北侧结合,且9B5在病毒衣壳上的结合足迹(footprint)可以掩盖吸附受体硫酸肝素的结合位点(图p),从而抑制CVA16病毒与硫酸肝素受体结合。8C4结合在CVA16的三重轴上(图j)。有趣的是,8C4只结合紧凑构象的C1和C2状态,而不结合膨胀构象C3(图j-o)。此外,研究人员发现8C4与SCARB2在衣壳上的结合位点和空间上均有冲突(图q),揭示了8C4抗体抑制CVA16与SCARB2结合的结构基础。叠加CVA16-9B5-C1和CVA16-8C4-C1的冷冻电镜结构显示,8C4和9B5识别不同的、不重叠的表位(图r),因此这两种抗体可同时结合同一个CVA16病毒衣壳,组成非竞争性的抗体对。进一步分析表明,该抗体对显示出比单个抗体更强的中和能力,且展现出阻止病毒逃逸的能力。与此相对的是,当使用单个抗体时,病毒逃逸容易发生。
综上,该研究研发了一对独特的CVA16中和性单抗,揭示了它们不同的结合表位以及中和作用机制。这对抗体的组合可作为抗人类CVA16感染的广谱治疗剂展开进一步开发,具有重要的理论意义和潜在的临床转化价值。
上海巴斯德所副研究员张超,分子细胞卓越中心博士生刘彩璇,上海巴斯德所毕业博士生石金平为本文并列第一作者。上海巴斯德所黄忠研究员和分子细胞卓越中心丛尧研究员为本文共同通讯作者。该研究得到了中国科学院、国家科技部、国家自然科学基金、上海市科委等的资金支持;还得到国家蛋白质科学研究(上海)设施冷冻电镜系统的大力协助。
文章链接:https://www.nature.com/articles/s41467-022-35575-w
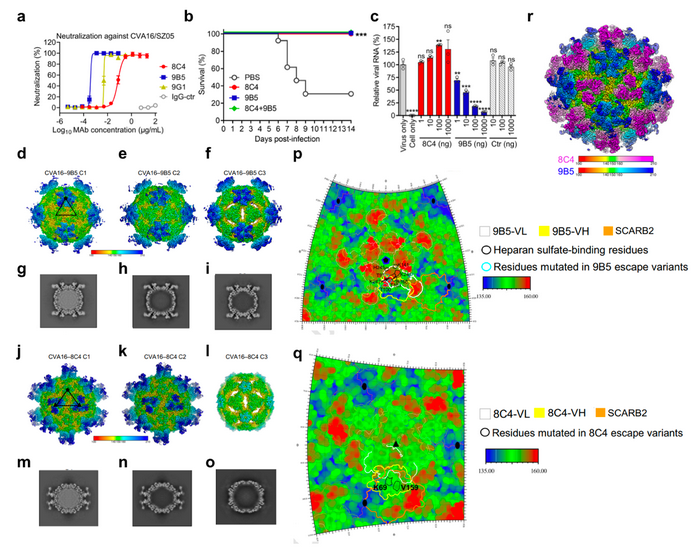
a-b, CVA16单抗8C4和9B5对CVA16活病毒的中和活性(a)及体内治疗效果(b)。c, 9B5而非8C4的预处理可以剂量依赖地抑制CVA16活病毒对宿主细胞的吸附。d-f, j-l CVA16-9B5(d-f)及CVA16-8C4(j-l) 复合体的系列冷冻电镜结构。C1和C2中CVA16为紧凑构象,C3中CVA16为膨胀构象。g-i, m-o, CVA16-9B5(g-i)和CVA16-8C4(m-o)三种状态电镜密度图的中央切片。显示C2和C3状态CVA16腔内不含病毒RNA。p, 9B5在病毒衣壳上的结合足迹。q, 8C4在病毒衣壳上的结合足迹。r, 叠加CVA16-9B5-C1和CVA16-8C4-C1的冷冻电镜结构,显示8C4和9B5识别不同的、不重叠的表位。
