分子细胞卓越中心利用双重组酶揭示胰腺导管细胞和腺泡细胞之间命运转变
文章来源:分子细胞科学卓越创新中心 | 发布时间:2023-01-20 | 【打印】 【关闭】
1月3日,国际学术期刊Cell Discovery在线发表了中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)周斌研究组的研究成果“Use of a dual genetic system to decipher exocrine cell fate conversions in the adult pancreas”。该研究开发了可以同时示踪胰腺外分泌部导管细胞和腺泡细胞的双同源重组酶介导的谱系示踪新技术,利用该技术揭示了在特定条件下,胰腺导管细胞和腺泡细胞可以发生细胞命运转变。该研究为胰腺炎等相关疾病的临床治疗提供了一定理论基础。
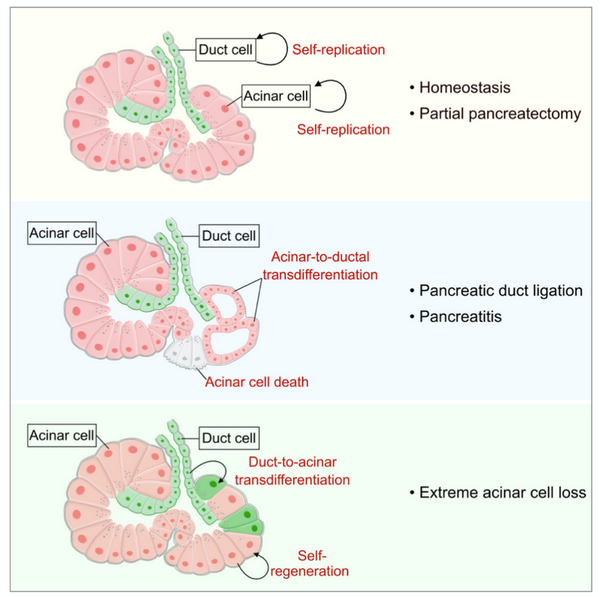
胰腺是体内仅次于肝脏的第二大腺体,其中,外分泌部构成了胰腺的绝大部分,主要由腺泡细胞和导管细胞构成。腺泡细胞可以产生和释放大量消化酶,包括淀粉酶、脂肪酶等,这些消化酶经过胰腺导管输送到十二指肠,对于机体消化过程发挥了重要作用。在胰腺中,外分泌导管细胞和腺泡细胞是否可以在生理病理条件下发生谱系转变仍具有一定争议。传统基于Cre-loxP的多项遗传示踪工作对于胰腺外分泌部细胞谱系转变具有不同的结果。揭示胰腺导管细胞和腺泡细胞命运转变可以为胰腺相关疾病的预防和靶向治疗提供一定帮助和依据。
为了系统研究胰腺外分泌部细胞谱系命运转变,研究人员建立了一种可以同时示踪胰腺导管细胞和腺泡细胞的新型双同源谱系示踪技术。研究人员发现Tnni3-Dre和正交位点特异性双同源重组系统交叉型报告小鼠IR1在胰腺外分泌部中可以特异性标记腺泡细胞,而基本不标记其他类型的细胞,可以避免CK19-CreER小鼠对于腺泡细胞的“非特异性标记”,该设计实现用两个不同的永久遗传报告基因标记胰腺导管细胞和腺泡细胞:zsGreen和tdTomato。
利用该系统,研究人员发现在稳态和胰腺切除情况下,胰腺导管细胞和腺泡细胞主要来源于自我复制,而在胰腺导管结扎和雨蛙素诱导的胰腺炎模型中,一部分胰腺腺泡细胞发生形态转变成管状结构,并不再表达腺泡细胞标记物,细胞命运转变成导管细胞。而在利用白喉毒素介导清除大部分胰腺腺泡细胞后,可以看到胰腺导管细胞参与贡献部分腺泡细胞。利用单细胞测序技术发现,导管细胞转变成为腺泡细胞经历了一个不成熟腺泡细胞的过程,说明胰腺导管细胞同样具有向腺泡细胞转分化的潜能。该研究工作对胰腺炎等相关疾病发病机制的深入挖掘及疾病治疗研究等提供新的研究工具和思路。
分子细胞卓越中心周斌研究组副研究员赵欢博士、助理研究员黄秀珍以及博士生刘子鑫为该论文共同第一作者,周斌研究员为该论文通讯作者。该工作得到上海南方模式生物公司及分子细胞卓越中心动物平台和细胞分析技术平台的大力支持,并得到来自中科院、基金委、科技部以及上海市科委等部门的经费支持。
文章链接:https://www.nature.com/articles/s41421-022-00485-0
胰腺导管细胞和腺泡细胞之间命运转变
