分子细胞卓越中心揭示新冠病毒蛋白质水解酶Nsp5切割宿主tRNA修饰酶TRMT1的分子机制
文章来源:分子细胞科学卓越创新中心 | 发布时间:2023-05-06 | 【打印】 【关闭】
4月18日,国际学术期刊Journal of Molecular Cell Biology在线发表了中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)周小龙研究组题为“SARS-CoV-2 main protease Nsp5 cleaves and inactivates human tRNA methyltransferase TRMT1” 的最新研究成果。该项工作揭示了新冠病毒蛋白质水解酶Nsp5切割宿主tRNA修饰酶TRMT1的分子机制。
由严重急性呼吸系统冠状病毒2型(SARS-CoV-2)引起的COVID-19对全球公共卫生构成严重威胁。SARS-CoV-2感染宿主细胞后,其基因组首先翻译产生多肽蛋白质pp1a、pp1ab,并进一步通过蛋白质酶水解方式产生16种非结构性蛋白质(nonstructural protein, Nsp),包括主蛋白酶Nsp5 (又称Mpro)。Nsp5特异性识别并切割pp1a及pp1ab保守位点,对于病毒复制转录复合体的形成、病毒基因的复制和转录具有决定性作用。基于Nsp5在病毒生命周期的核心作用,针对Nsp5的结构与功能研究,以及靶向Nsp5催化中心的药物设计与筛选成为研究热点。除病毒基因组编码的pp1a和pp1ab外,一些宿主蛋白也同样被预测或证实是Nsp5的潜在底物。例如有研究表明Nsp5可以靶向切割自噬调节元件p62,致使其失去识别泛素化底物和结合自噬因子招募底物到自噬小体的功能,使新型冠状病毒免受选择性自噬通路的降解。
SARS-CoV-2蛋白质与人类蛋白质互作网络的系统研究揭示,Nsp5酶活缺陷体Nsp5 C145A与人细胞tRNA甲基转移酶TRMT1存在相互作用。TRMT1负责催化形成人细胞质和线粒体部分tRNA第26位的N2-甲基鸟苷(m2G)和N2,N2-二甲基鸟苷(m2,2G)修饰。tRNA的转录后修饰对于促进tRNA折叠、维持tRNA结构、调节密码子与反密码子的相互作用等具有至关重要的作用。然而,TRMT1是否为Nsp5体内的真正底物以及TRMT1被Nsp5切割的细胞功能尚不清楚。
本研究中,研究人员通过免疫印迹、蛋白质纯化等方法证实,在体外条件下,SARS-CoV-2 Nsp5和序列高度一致的SARS-CoV Nsp5均能够高效切割TRMT1;基于NetCorona软件,预测TRMT1的Q530位点为Nsp5高可信度的切割位点;在细胞水平上明确Nsp5能够体内切割TRMT1的Q530位点,而没有催化活性的Nsp5 C145A突变体则丧失切割能力;通过构建蛋白质水解报告系统,进一步证实TRMT1作为Nsp5的靶向切割底物;最后通过重组TRMT1介导的m2G/m2,2G修饰活力实验,证明Nsp5对底物TRMT1的切割会破坏修饰酶的催化功能区域,导致TRMT1的切割形式丧失了对底物tRNA的修饰能力,从而可能进一步下调了宿主mRNA的翻译。
本研究通过体内与体外实验,明确了人tRNA修饰酶TRMT1为SARS-CoV-2 Nsp5的酶切底物,揭示了TRMT1中Nsp5的切割位点,并进一步证明了TRMT1的切割产物丧失其原有的tRNA修饰活力。这些研究结果加深了对新冠病毒蛋白质水解酶Nsp5在细胞内与宿主蛋白质相互作用及其可能效应的认识,为揭示新冠病毒感染过程中,宿主细胞mRNA翻译的选择性抑制提供了新的视角。
分子细胞科学卓越创新中心博士研究生鲁嘉莉为本文第一作者,周小龙研究员为本文通讯作者。本研究得到国家重点研发计划、基金委、中科院以及上海市的经费资助。
文章链接:https://doi.org/10.1093/jmcb/mjad024
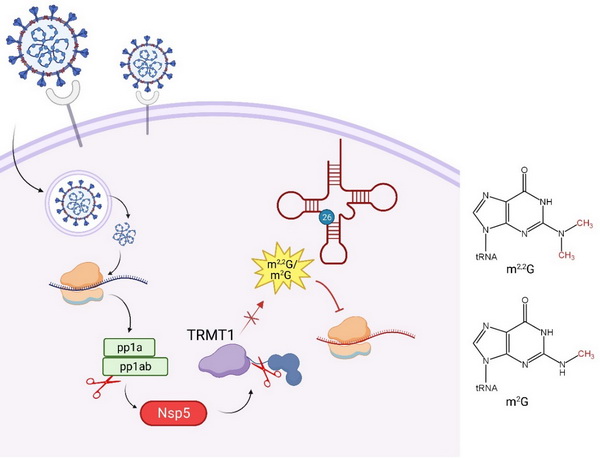
Nsp5通过切割TRMT1以抑制其tRNA修饰活力
