分子细胞科学卓越创新中心许琛琦研究员合作发表免疫受体静电相互作用长篇综述
文章来源:分子细胞科学卓越创新中心 | 发布时间:2023-07-14 | 【打印】 【关闭】
6月27日,国际学术期刊Immunological Reviews在线刊登了中国科学院分子细胞科学卓越创新中心许琛琦研究员和上海科技大学王皞鹏教授联合发表的长篇综述:Charging CAR by Electrostatic Power,总结了静电相互作用在天然免疫受体以及人工合成免疫受体的信号传导中发挥的作用,并提出了基于电荷的相互作用来设计嵌合抗原受体(CAR-T)细胞疗法的策略。
CAR-T细胞疗法是一种新兴的免疫细胞疗法,在临床上已广泛应用于治疗恶性肿瘤。该疗法中使用的CAR是一种人工合成的抗原受体,具有特异性识别肿瘤抗原和激活T细胞信号通路的作用。虽然CAR-T疗法在血液瘤治疗中已展现出较好的临床效果,但是,目前的CAR设计依然存在许多问题,需要进一步优化和改进。CAR受体的信号缺乏完善的调控机制,因此会产生过强或过弱的信号导致CAR-T细胞过早耗竭或增殖能力受损。一些天然的免疫受体如T细胞受体(TCR)的信号传递则兼具高灵敏度和高效率的特点,能够更好的传递信号。已有研究指出:许多免疫受体的信号调控依赖于电荷介导的分子间相互作用,并且CAR分子的信号传递也受到电荷影响。因此,深入了解静电相互作用调节天然免疫受体信号的机制将对CAR分子的设计和优化带来启发。
本文首先系统性地总结了在天然免疫受体中静电相互作用对信号传递的调控作用,并根据带电残基的位置将电荷调控作用分为两类:一是位于受体胞外端的电荷能够驱动免疫受体的自发聚集。如T、B细胞发育过程中必不可少的Pre-TCR/Pre-BCR的表面都具有富集的带电残基,使受体之间相互吸引发生寡聚化,从而向下游传递信号,帮助T、B细胞进一步发育。二是位于受体胞内端的电荷能够调控下游信号传导。以TCR为例,其胞内端(CD3ε/ζ链)的碱性氨基酸富集序列(BRS),在T细胞处于静息状态时与细胞膜中带负电荷的酸性磷脂发生相互作用粘附在膜上,阻止T细胞自激活。当TCR与抗原结合后, CD3链与细胞膜解离其中的正电荷发挥招募下游信号分子的作用,进一步调控T细胞激活信号。
与天然受体类似,CAR受体上的电荷分布也会影响其信号传导。本文从电荷相互作用角度出发,总结了目前通过改变CAR分子电荷特性来增强CAR-T细胞功能的优化策略。对于CAR的胞内端,通过添加带有正电荷的CD3ε链,能够有效改善CAR分子的信号传导,增强CAR-T细胞的功能。对于CAR的胞外端,通过改变scFv区域的正电荷斑块(PCP)大小能够控制CAR分子的自发聚集程度,从而调控CAR-T细胞的基底信号(Tonic signal)。针对CAR-T细胞的基底信号,本文还提出了峰尖理论(Peak Theory):CAR的基底信号过高或过低都会对CAR-T功能带来不利影响,通过改进和优化将基底信号调节在最适强度范围时才能够让CAR-T细胞获得最佳的临床疗效。
本文聚焦于静电相互作用对天然或人工的免疫受体的调控模式,提出通过修改CAR分子的电荷来增强CAR-T细胞功能的优化策略,为新型CAR-T细胞疗法的设计和研发提供新方向。
分子细胞卓越中心许琛琦研究员和上海科技大学王皞鹏研究员为该论文的共同通讯作者。该项工作得到了来自中科院青年团队和上海市基础特区项目的支持。
文章链接:https://doi.org/10.1111/imr.13232
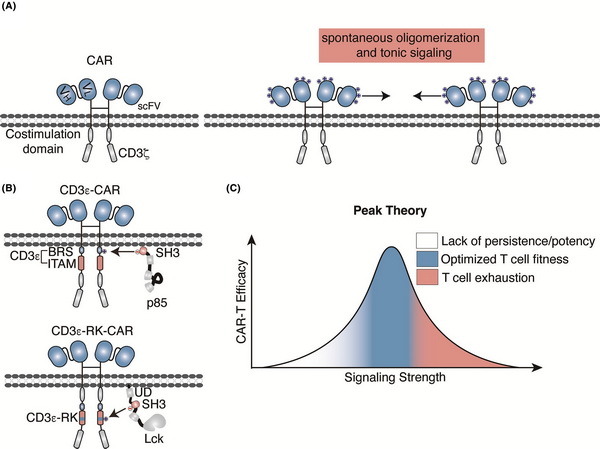
基于静电相互作用来改造CAR-T细胞疗法
