周波组合作建立高通量单细胞代谢组技术解析造血干细胞异质性
文章来源:分子细胞科学卓越创新中心 | 发布时间:2024-01-08 | 【打印】 【关闭】
1月2日,国际学术期刊Cell Metabolism在线发表了中国科学院分子细胞科学卓越创新中心周波研究组、华东师范大学万晶晶教授和上海交通大学钱昆教授的合作研究成果:“Deciphering the metabolic heterogeneity of hematopoietic stem cells with single-cell resolution”。该工作从头搭建了一套结合抗体染色、预固定、流式分选、自动化样品处理以及基质辅助的激光解吸电离质谱技术的高通量单细胞代谢组分析平台(high-throughput single-cell metabolomics, hi-scMet),能够从单细胞中检测到超过100个代谢物。基于此技术,该工作成功绘制了造血谱系全细胞代谢组图谱,揭示了造血干细胞扩增过程中的代谢转变,也证明了磷酸戊糖途径在造血干细胞激活中的作用。
造血干细胞(hematopoietic stem cell)是一类非常稀少的干细胞,能够通过自我更新及多系分化建立起完整且成熟的血液系统。在发育的不同阶段,造血干细胞的代谢状态也发生了巨大的变化。为了满足造血需求,造血干细胞会在胚胎时期快速增殖分裂,小鼠出生后,造血需求逐渐降低,造血干细胞会暂停分裂,进入长期静息状态。得益于质谱技术的发展,造血干细胞代谢相关研究越来越丰富,已经有不少研究人员利用液相质谱(liquid chromatography–mass spectrometry)技术证明了数种代谢物及其通路能够直接参与造血干细胞功能调控。然而,造血干细胞并非是一个均匀的整体,传统的液相质谱技术难以用于细胞的异质性分析,在检测通量上也有着明显的局限性,因此如何高通量地在单细胞水平解析造血干细胞的代谢组将是下一个挑战。
周波研究组分离了成体小鼠骨髓中的12种血系细胞,共计1428个细胞进行了单细胞代谢组分析,利用hi-scMet技术平台绘制了整个造血谱系的单细胞代谢组图谱,此外,团队引入了TetO-H2B-GFP;R26rtTA小鼠模型,将造血干细胞分为4个自我更新能力不同的亚群。结果证明,造血干细胞亚群的代谢水平呈现出趋势性变化,自我更新能力越强的造血干细胞越偏向于维持在低代谢活性状态,其中33个代谢物出现了显著性的趋势性变化。在这之中,有不少物质参与糖代谢,例如葡萄糖、乳酸、苹果酸与6-磷酸葡糖酸(6PG)等。
为了确定6PG所在的磷酸戊糖途径是否能在体内调控造血干细胞的功能,周波研究组设计并引入了6PG合成酶基因敲除小鼠Pgls+/-以及磷酸戊糖途径抑制剂6-AN。结果发现, Pgls基因敲除的造血干细胞在长期移植重建时表现出更弱的血液系统重建能力;6-AN注射也会显著抑制造血干细胞及祖细胞的重建过程。这证明基因敲除或药物抑制磷酸戊糖途径都会导致造血干细胞的自我更新能力受损。
总之,该项研究成功建立了基于流式分选的单细胞代谢组分析平台,弥补了过去代谢组分析在灵敏度、通量、细胞完整性与靶向性不能俱全的问题,成功绘制了造血谱系全细胞代谢组图谱,证明了造血干细胞处于更低的代谢活性,发现了磷酸戊糖途径能调控造血干细胞的自我更新能力。
上海交通大学曹敬博士生、分子细胞卓越中心姚颀博士生和上海交通大学吴娇博士生为该论文的共同第一作者。分子细胞卓越中心周波研究员为该论文的责任通讯作者,华东师范大学万晶晶教授和上海交通大学钱昆教授为该论文的共同通讯作者。该项工作得到了中国科学院、基金委、科技部等项目的资助以及分子细胞卓越中心动物实验技术平台和细胞分析技术平台的帮助与支持。
文章链接:https://doi.org/10.1016/j.cmet.2023.12.005
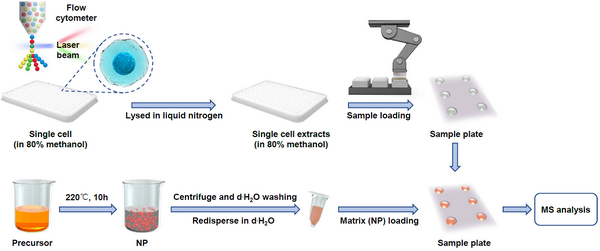
高通量单细胞代谢组解析平台示意图
