分子细胞科学卓越创新中心许琛琦组合作揭示肠癌“非同步”胆固醇合成通路诱导炎性微环境的新机制
文章来源:分子细胞科学卓越创新中心 | 发布时间:2024-01-15 | 【打印】 【关闭】
1月2日,国际学术期刊EMBO Molecular Medicine在线发表了中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)许琛琦研究员、中国科学院上海有机化学研究所生物与化学交叉中心朱正江研究员与上海交通大学附属第六人民医院王志刚教授的最新研究成果“Shaping immune landscape of colorectal cancer by cholesterol metabolites”。该工作阐明了肠癌的“非同步”胆固醇合成通路产生胆固醇前体累积,从而诱导促炎型Th17细胞的新机制。
肿瘤免疫治疗近年来获得巨大突破,但是很多肿瘤类型对肿瘤免疫治疗的响应很差。根据其错配修复酶的缺失与否,肠癌可分为微卫星稳定型(MSS CRC)和微卫星不稳定型(MSI CRC)。MSS CRC占肠癌 85% 左右,对免疫检查点阻断疗法几乎不响应,而MSI CRC则有很高的响应率,表明这两类肿瘤亚型具有差异性的免疫微环境。在MSS CRC中,促炎型的Th17细胞显著富集,促进肠癌的进展并且抑制免疫检查点阻断疗法的响应率。然而Th17的富集原因却不清楚。
在该项工作中,研究团队发现MSS CRC细胞能够特异性地诱导Th17分化,而MSI CRC则没有这个能力。MSS CRC细胞中,MYC异常活化后上调胆固醇合成通路SQLE等关键上游基因的表达,然而合成通路的最后一个酶DHCR24则不受MYC调控,因此没有上调。这种“非同步”的合成通路造成Desmosterol等胆固醇前体的累积。Desmosterol等胆固醇前体可以直接活化核受体RORgt,促进Th17的分化。靶向抑制肠癌细胞中胆固醇合成酶CYP51A1,可以降低胆固醇前体的累积,从而抑制Th17细胞的富集,进而下调髓系细胞的免疫抑制活性并上调T细胞的杀伤活性,促进抗肿瘤免疫反应。该工作揭示了肿瘤胆固醇代谢的免疫调控新机制,并提出了一种MSS CRC治疗的新策略。
分子细胞卓越中心博士后白轶冰、博士研究生汪钦数、上海有机化学研究所生物与化学交叉中心博士研究生李彤洲以及上海交通大学博士研究生尤伟强为该论文的共同第一作者。分子细胞卓越中心许琛琦研究员、上海有机化学研究所生物与化学交叉中心朱正江研究员与上海交通大学附属第六人民医院王志刚教授为该论文共同通讯作者。北京大学张泽民教授、上海免疫与感染研究所郝沛研究员、分子细胞卓越中心陈剑峰研究员、杨巍维研究员、王广川研究员、柳欣研究员、武汉大学宋保亮教授以及上海营养与健康研究所钱友存研究员等对该工作给予了大力支持。该项工作得到了中国科学院、基金委、科技部等项目的资助,以及分子细胞卓越中心分子生物学技术平台、细胞分析技术平台、化学生物学技术平台、动物实验技术平台和细胞库/干细胞技术平台的帮助与支持。
文章链接:https://www.embopress.org/doi/full/10.1038/s44321-023-00015-9
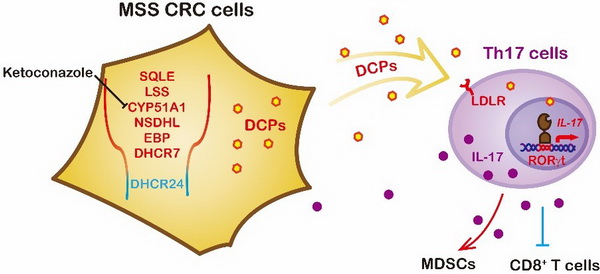
肠癌“非同步”胆固醇合成通路的免疫调控机制及干预策略
