糖尿病(Diabetes)是一种以高血糖为主要表现的综合性代谢性疾病(1),主要分为1型糖尿病(Type 1 Diabetes, T1D)、2型糖尿病(Type 2 Diabetes, T2D)、妊娠糖尿病(Gestational Diabetes, GD)和特殊类型糖尿病。中国是糖尿病第一大国,患病人数占全球糖尿病总患病人口的四分之一(2, 3)。T2D是糖尿病中最常见的类型,占中国糖尿病患者的90%以上。据2023年最新统计数据显示,中国糖尿病患者的综合治疗(包括血糖、血脂、血压)达标率仅4.4% (4),这意味着由糖尿病代谢记忆效应所带来的全身多器官并发症必将成为我国未来的重大健康经济负担。现有上市药物均表现出较好的降糖效果,但随着用药时间延长,出现药效降低及 细胞衰减加速、低血糖、体重增加等副作用,未能从根本上解决胰岛 细胞凋亡、衰竭的根源性病理。因此,从分子病理机制上寻找胰岛 细胞功能衰竭的内在原因、发现潜在的创新药物研发靶点并发现潜在候选药物,缓解 细胞凋亡、恢复 细胞功能是治疗T2D并实现糖尿病缓解的根本策略。
线粒体功能及ATP产生效率关系着胰岛 细胞葡萄糖刺激的胰岛素释放(Glucose Stimulated Insulin Secretion, GSIS)功能(5)。线粒体代谢也是胰岛 细胞分泌胰岛素的主要决定因素(6)。线粒体质量控制(Mitochondrial Quality Control, MQC)对维持 细胞健康与功能至关重要(7-9)。越来越多的证据表明,线粒体功能障碍在 细胞衰竭过程中发挥重要作用,如显性T2D可表现为 细胞中线粒体氧化磷酸化能力的获得性或遗传性降低、线粒体可塑性以及线粒体含量的降低(10);线粒体的单基因功能障碍和线粒体来源ROS产生均会诱导 细胞衰竭导致2型糖尿病样综合征(11, 12)。
中国科学院上海药物研究所李静雅团队,长期致力于探索代谢性疾病中的线粒体稳态失衡分子机制。近年来针对营养与环境诱导的疾病模型肝、肾和脂肪组织中线粒体稳态失衡,开展调控机制以及干预策略研究,相关学术论文发表于Cell Metabolism (2021)、Kidney International (2021)、Acta Pharmaceutica Sinica B (2023)和Diabetes (2019&2021)等期刊。谭敏佳课题组主要从事基于蛋白组学技术的蛋白修饰调控机制和药物精准干预策略研究,发表于Cell Metabolism (2021)、Molecular Cell (2021) 、Cell (2018&2020) 等研究工作突破了对多种蛋白翻译后修饰在生理病理过程中的多样性、动态性、交互性等复杂特征的认知局限。
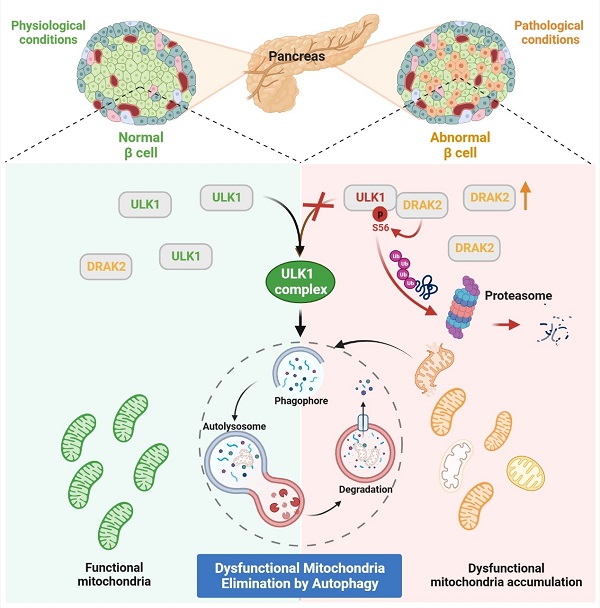
2024年02月07日,李静雅课题组和谭敏佳课题组合作,联合浙江大学基础医学院孟卓贤课题组、上海交通大学附属仁济医院吴琳石研究团队于Science Translational Medicine杂志发表题为“DRAK2 suppresses autophagy by phosphorylating ULK1 at Ser56 to diminish pancreatic cell function upon overnutrition”的研究成果。研究首次揭示了DRAK2(死亡相关凋亡诱导蛋白激酶2)与自噬/线粒体自噬起始复合物关键蛋白ULK1存在相互作用并磷酸化ULK1-Ser56位点后,促进其泛素化降解、阻滞线粒体自噬介导线粒体稳态失衡的分子机制,为糖尿病缓解提供了潜在干预靶标。
研究人员在高血糖人临床胰腺样本以及糖尿病猴胰腺样本中,均发现DRAK2蛋白异常高表达。在糖尿病模型小鼠(db/db小鼠)胰腺中也检测到DRAK2蛋白水平增加,自噬受阻及凋亡增加的现象。通过构建胰岛 细胞中特异性敲除Drak2-cKO的小鼠,发现Drak2-cKO小鼠能够抵抗高脂饮食诱导的胰岛功能损伤;透射电镜结果发现Drak2-cKO小鼠胰岛 细胞的线粒体和胰岛素囊泡的质量与数量均优于对照小鼠,且能观察到明显的(包裹线粒体)自噬小体。机制上,通过Drak2-cKO小鼠胰岛磷酸化蛋白质组学分析,挖掘到ULK1是DRAK2参与自噬调控的潜在底物,证明了DRAK2能够与ULK1相互作用,并确认ULK1的Ser56是DRAK2直接磷酸化修饰新位点。通过ULK1-S56A突变可逆转DRAK2过表达造成的 细胞线粒体功能和糖刺激胰岛素分泌能力(Glucose Stimulated Insulin Secretion, GSIS)损伤,论证了DRAK2通过与ULK1互作并直接磷酸化ULK1-Ser56位点、促进ULK1泛素化降解而负调控自噬、损伤线粒体质量和 细胞功能的分子机制。
为论证DRAK2-ULK1调节轴在胰岛 细胞损伤与高血糖症发展中的作用,研究人员利用已报道的DRAK2工具抑制剂22b进行体内外功能评价,发现22b能够改善临床捐献的人胰岛功能、改善INS-1E细胞线粒体功能;可改善db/db小鼠糖耐量,增强小鼠胰岛响应葡萄糖刺激释放胰岛素的能力,维持小鼠胰岛中ULK1蛋白水平。论证了靶向胰腺DRAK2可实现线粒体功能保护、 细胞功能保护,缓解糖尿病病症的可行性。
综上,此研究首次论证了DRAK2-ULK1轴介导 细胞线粒体质量控制的分子机制,增加了科研人员对于线粒体受损在T2D病理发展作用的认识。揭示胰岛 细胞功能损伤和线粒体稳态失衡的新病理分子机制,为治疗T2D和糖尿病缓解提供了潜在药物靶标。
图1. DRAK2-ULK1介导胰岛 细胞线粒体稳态调控的分子机制
上海药物所副研究员卢玉婷、徐骏宇、李玉峰,中国科学院大学杭州高等研究院博士后王若然、博士研究生戴成球,为本文共同第一作者。上海药物所李静雅研究员、谭敏佳研究员,浙江大学基础医学院孟卓贤研究员及上海交通大学附属仁济医院吴琳石副主任,为本文共同通讯作者。华东师范大学汤杰教授、杨帆教授为本项目做出重要贡献。该工作得到国家自然科学基金委重大研究计划培育项目、上海市自然基金委、浙江省自然基金委等项目的资助。特别感谢上海药物所李佳研究员、徐华强研究员,海军军医大学章卫平教授,蒙特利尔大学吴江平教授,密歇根大学林建谍教授、芮良优教授和墨尔本皇家理工大学叶冀明教授在课题研究中给予的建设性意见和专业领域支持。
参考文献
1.N. A. ElSayed et al., 2. Classification and Diagnosis of Diabetes: Standards of Care in Diabetes-2023. Diabetes Care 46, S19-S40 (2023).
2.R. C. W. Ma, Epidemiology of diabetes and diabetic complications in China. Diabetologia 61, 1249-1260 (2018).
3.Y. Zheng, S. H. Ley, F. B. Hu, Global aetiology and epidemiology of type 2 diabetes mellitus and its complications. Nature Reviews. Endocrinology 14, 88-98 (2018).
4.V. W. Zhong et al., Achievement of Guideline-Recommended Targets in Diabetes Care in China : A Nationwide Cross-Sectional Study. Ann Intern Med 176, 1037-1046 (2023).
5.A. Wiederkehr, C. B. Wollheim, Minireview: Implication of mitochondria in insulin secretion and action. Endocrinology 147, 2643-2649 (2006).
6.B. A. Kaufman, C. Li, S. A. Soleimanpour, Mitochondrial regulation of beta-cell function: maintaining the momentum for insulin release. Mol Aspects Med 42, 91-104 (2015).
7.V. Sidarala et al., Mitophagy protects beta cells from inflammatory damage in diabetes. Jci Insight 5, (2020).
8.G. Pearson, S. A. Soleimanpour, Visualization of Endogenous Mitophagy Complexes In Situ in Human Pancreatic Beta Cells Utilizing Proximity Ligation Assay. Jove-J Vis Exp, (2019).
9.A. Goginashvili et al., Insulin secretory granules control autophagy in pancreatic beta cells. Science 347, 878-882 (2015).
10.J. Szendroedi, E. Phielix, M. Roden, The role of mitochondria in insulin resistance and type 2 diabetes mellitus. Nat Rev Endocrinol 8, 92-103 (2011).
11.J. A. Maassen et al., Mitochondrial diabetes: molecular mechanisms and clinical presentation. Diabetes 53 Suppl 1, S103-109 (2004).
12.S. Lim et al., Mitochondria-targeted antioxidants protect pancreatic beta-cells against oxidative stress and improve insulin secretion in glucotoxicity and glucolipotoxicity. Cell Physiol Biochem 28, 873-886 (2011).