PNAS | 上海药物所合作揭示药物载体高效递释的物理药剂学新机制
文章来源:上海药物研究所 | 发布时间:2024-05-22 | 【打印】 【关闭】
2024年05月21日,中国科学院上海药物所甘勇研究员与国家纳米中心施兴华研究员合作团队于《美国科学院院刊》(PNAS)在线发表了以“Curvature-mediated Rapid Extravasation and Penetration of Nanoparticles against Interstitial Fluid Pressure for Improved Drug Delivery”为题的研究论文。该研究为设计高效递释的药物载体以克服体内复杂屏障提供全新思路。

药物载体可精准调控活性分子(包括小分子、多肽、蛋白质和核酸等)在体内的时间和空间分布,在改善药物的安全性和有效性方面具有重要的作用。然而,载体在真实生物体内往往面临着复杂的生理和病理屏障,严重限制了其递药效率。在抵达靶位之前,载体需“翻山越岭”地克服酶屏障、血液循环屏障、组织渗透屏障、细胞屏障及胞内转运屏障等多重障碍;这些屏障极大地限制了药物载体的输送过程,使得到达靶组织内的药物仅有不到0.7%。为了有效应对这些挑战,深入理解药物载体与生物屏障之间的相互作用至关重要。近年来的研究表明,载体的物理属性,如形状、刚度、尺度和表面性质,是决定其与生物屏障相互作用的关键因素,有望通过调控载体的物理属性而提高药物的安全性和有效性。
在本项研究中,研究团队独立设计并合成了多种不同形状的药物载体,并通过透射电子显微镜等技术进行了详细表征。在实验中发现,与球形、椭球形及棒形载体相比,尖锐梭形的纳米载体(ENP5)在体内外高间质压环境中展现出更优异的外渗和内渗能力。在小鼠模型中评价了负载化疗药物阿霉素(Dox)的不同形状载体的抗肿瘤药效。与对照组相比,Dox@ENP5对肿瘤的抑制显著增强,其肿瘤抑制率高于90%,并延长HCC肝癌小鼠的生存周期。
进一步,通过结合超高分辨率显微镜观测和分子模拟技术,研究团队对载体克服高间质压屏障的三维运动模式及其力学机制进行了深入研究。研究发现,在血管外渗过程中,载体的高曲率有助于减少由压力梯度产生的流体阻力,加速梭形载体的迁移速度;在组织内渗过程中,高曲率通过促进载体的旋转运动,增加其在高压密集的细胞外基质中的跳跃频率,有效加速了载体向肿瘤深层的穿透,显著提升了药物的递送效率(图1)。
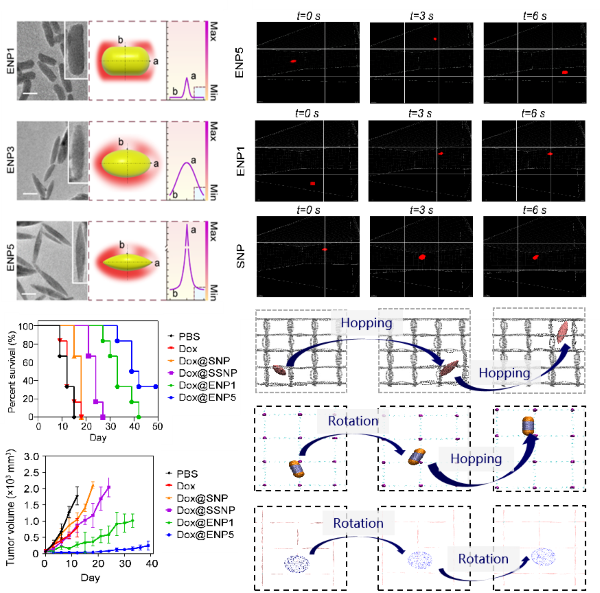
图1. 曲率介导载体高效输运的效果及微观机制
此外,团队近期也发现了表面性质调控药物载体递释的一些规律和机制,相关研究成果于2024年02月发表于国际主流期刊Nature Communications。当纳米载体进入机体时,生物环境中的大量蛋白质吸附到纳米载体表面,形成复杂、多变的蛋白冠,严重影响纳米载体的血液循环、细胞摄取等行为。团队探究了表面不同氨基/羟基比的纳米囊泡对体内蛋白冠组成及其对后续体内行为的影响,研究发现:氨基/羟基比约为0.4的CP-LVs(CP1-LVs)可通过延长血液循环和增强肿瘤细胞摄取,提高药物在肿瘤组织中的递送效率。微观机制探究显示,CP1-LVs可有效抑制血液和肝脏中免疫球蛋白的吸附,延长血液循环;同时吸附肿瘤间质液中丰富的肿瘤特异性蛋白(如CD44和骨桥蛋白),促进肿瘤细胞摄取,提高药物的肿瘤递送效率。
近年来,甘勇团队致力于药物载体高效递释的物理药剂学研究,在该领域取得了一定成果,发现形状、刚度和表面性质等属性影响载体输运效率和靶位释放的规律及微观机制。相关成果陆续发表于Nature Communications (2018, 2022, 2024), Science Advances (2020), PNAS (2019), Journal of Extracellular Vesicles (2022)等国际主流期刊,为理性化设计高效递释的药物载体以克服体内复杂屏障提供了全新思路。
上海药物所博士生姜小荷、博士后缪云秋和国家纳米中心博士生徐赛为本文共同第一作者。上海药物所甘勇研究员、俞淼荣副研究员和国家纳米中心的田发林副研究员为本文的共同通讯作者。该研究获得了上海药物所张馨欣研究员的大力支持,以及国家蛋白质科学中心(上海)的复合激光显微成像系统和电镜分析系统的帮助。该研究得到了国家杰出青年科学基金、中国科学院重点研究项目等资助。
