孙衍刚组解析单细胞投射谱助力内源性镇痛作用神经环路机制研究
文章来源:脑科学与智能技术卓越创新中心 | 发布时间:2024-06-07 | 【打印】 【关闭】
2024年6月4日,《National Science Review》期刊在线发表了题为《基于单神经元全脑投射谱解析内源性阿片镇痛的神经环路机制》的研究论文,该研究由中国科学院脑科学与智能技术卓越创新中心(神经科学研究所)、脑认知与类脑智能重点实验室孙衍刚研究组完成。
慢性疼痛是一个重大的公共健康问题。在所有止痛药中,阿片类药物表现出强效的止痛效果,但阿片类药物长期使用引起成瘾等不良反应,限制了其临床应用。内源性阿片镇痛作用是机体的一种自我调节机制,四种阿片受体和四种内源性阿片肽组成了机体的内源性阿片系统。持续性疼痛引起皮层及皮层下脑区(丘脑、杏仁核、伏隔核等)的内源性阿片类物质释放,通过作用于mu型阿片受体(MOR)激活内源性阿片系统,进而发挥镇痛作用。本研究团队前期研究发现在炎症痛中,兴奋性神经元中表达的MOR介导吗啡的镇痛作用,而内源性阿片类物质的镇痛作用主要通过γ氨基丁酸(GABA)能抑制性神经元中表达的MOR实现(Zhang et al., 2020)。然而,内源性阿片类物质发挥镇痛作用的关键脑区及神经环路机制尚不明确。
杏仁中央核(CEA)是疼痛和情绪调控的重要节点,该脑区以抑制性神经元为主,并且密集表达MOR,这些信息提示CEA可能是内源性阿片类物质镇痛的关键靶点。在本研究中,研究团队发现选择性敲除CEA中的MOR显著性降低了内源性阿片镇痛作用,而在MOR全身敲除小鼠的CEA重新表达MOR后,小鼠恢复了内源性阿片镇痛作用,且该作用可被CEA局部给予MOR的特异性拮抗剂逆转,提示内源性阿片类物质通过CEA中表达的MOR发挥镇痛作用。研究团队利用光纤记录、脑片电生理结合药理学手段,发现在炎症痛过程中,机体释放的内源性阿片类物质通过激活CEA中的MOR抑制CEAMOR神经元,进而发挥镇痛作用。以上结果表明在内源性阿片镇痛中CEAMOR神经元发挥着核心作用。
为了解析CEAMOR神经元介导内源性阿片类物质镇痛作用的环路机制,研究团队绘制了CEAMOR神经元具有单细胞精度的全脑投射图谱,并基于投射特征定义了CEAMOR神经元的四种投射亚型。分析结果显示第一类亚型具有向后脑多个亚区投射的特点;而第二类亚型主要投射到以终纹床核为代表的前脑区域;第三和第四类亚型则主要表现局部投射模式。该研究进一步探究了前两类亚型在痛觉调控中的作用。研究人员发现抑制CEAMOR神经元第一类亚型中投射到臂旁核而非腹侧被盖区或导水管周围灰质的轴突分支可显著缓解小鼠炎症性痛,而抑制第二类亚型中投射到终纹床核的轴突分支并不影响小鼠炎症痛行为,表明存在亚型和轴突侧枝特异性的作用。进一步,研究团队发现CEAMOR神经元-臂旁核去抑制环路是内源性阿片类物质发挥镇痛作用的关键。
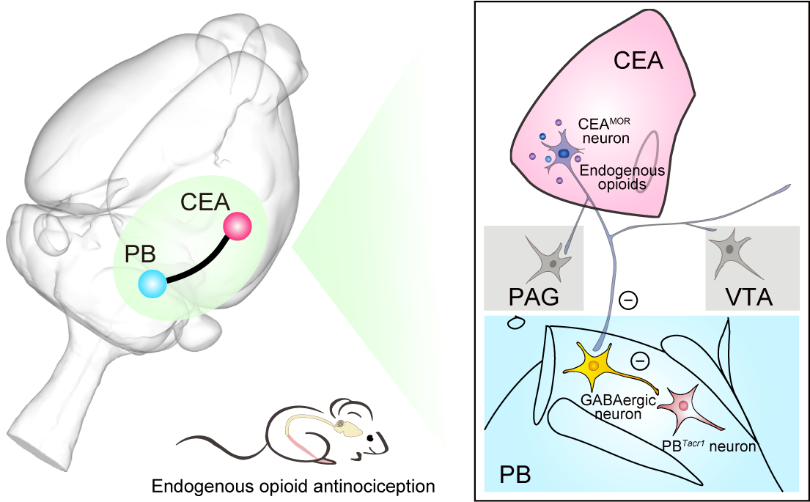
图注:内源性阿片类物质镇痛作用的神经环路机制示意图。
该项研究解析了内源性阿片类物质镇痛作用的神经环路机制,发现CEAMOR神经元-臂旁核去抑制环路介导了内源性阿片类物质的镇痛作用,对通过药理学和神经调控方法进行靶向治疗慢性痛具有指导意义。研究基于单神经元的全脑投射谱解析了特定类型神经元的功能,为深入解析神经网络的功能提供了新思路。
该项研究在中国科学院脑科学与智能技术卓越创新中心孙衍刚研究员的指导下,主要由窦艳侬博士完成,课题组成员刘媛、丁文群、李清、周华、李灵等做出了重要贡献,研究得到华中科技大学李安安教授、袁菁教授、中南大学湘雅医院邹望远教授以及脑智卓越中心王晓飞的大力支持。中国科学院脑智卓越中心全脑介观神经联接图谱研究平台、脑科学数据与计算中心、光学平台及啮齿类实验动物平台为本研究提供了重要的技术支撑。本项目得到了科技部、国家自然科学基金委员会、上海市、中国科学院、新基石科学基金会的资助。
