Cell Discov | 上海药物所揭示催乳素释放肽受体信号转导机制
文章来源:上海药物研究所 | 发布时间:2024-09-04 | 【打印】 【关闭】
2024年9月3日,中国科学院上海药物研究所徐华强/赵丽华团队在Cell Discovery发表了以“Molecular mechanism of prolactin-releasing peptide recognition and signaling via its G protein coupled receptor”为题的研究论文。该研究报道了PrRPR在内源性多肽PrRP20激活下,分别偶联下游Gq和Gi蛋白的冷冻电镜复合物结构,分辨率分别为2.96和2.97埃(图1),揭示了催乳素释放肽受体信号转导机制。
RF-酰胺肽是神经肽中的一种,其以羧基末端的精氨酸-苯丙氨酸-NH2(Arg-Phe-NH2,RF-amide)基序为共同特点,发挥着重要的神经递质和神经调质作用,参与了代谢、生殖和痛觉感受等一系列生理过程。在哺乳动物中,RF-酰胺肽受体家族主要包括:催乳素释放肽受体(PrRPR,GPR10)、神经肽FF受体1/2 (NPFF1R/NPFF2R,GPR147/GPR74)、kisspeptin受体(KISS1R,GPR54)和焦谷氨酰化RF-酰胺肽受体(QRFPR,GPR103)在内的5个受体成员。其中,催乳素释放肽(PrRP)可结合并激活催乳素释放肽受体(PrRPR),也称为GPR10。PrRP和PrRPR在哺乳动物中高度保守,参与调节食欲和能量代谢、应激反应、疼痛感受、以及心血管和生殖系统功能,是肥胖相关代谢性疾病治疗的潜在靶点。
催乳素释放肽PrRP前体经剪切形成两种不同长度的内源性多肽:PrRP20和PrRP31,PrRP20是由20个氨基酸组成的内源性神经肽,可通过Gq/11和Gi/o信号通路激活大量表达在丘脑网状核、下丘脑核、极后区、孤束核等区域的PrRPR,从而调节食物摄入、能量代谢、痛觉感受、应激反应、睡眠和节律等生理过程(图1)。目前已进行的多项针对PrRP类似物的构效关系研究主要集中于其C端RF-酰胺基序,这些研究表明,位于C端的关键氨基酸的改变将显著影响配体活性,其对于PrRP-PrRPR的相互作用至关重要。但是PrRP与受体相互作用并激活G蛋白的详细过程一直不清楚,揭示催乳素释放肽受体信号转导机制对开发针对肥胖、2型糖尿病、睡眠障碍和癫痫的药物具有重要意义。
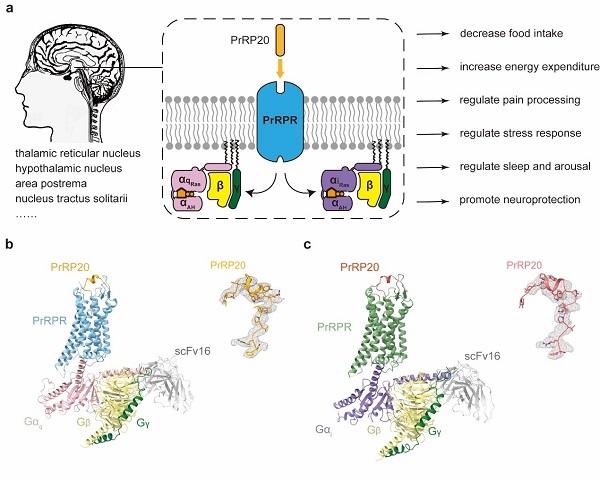
图1 (a)PrRP20介导的PrRPR的G蛋白信号传导通路及其生理作用示意图。(b)PrRP20-PrRPR-Gq-scFv16和 PrRP20-PrRPR-Gi-scFv16复合物的冷冻电镜结构。
本研究首先阐明了PrRPR中包括RF-酰胺基序识别口袋在内的配体结合口袋,结构和功能分析显示,RF-酰胺基序中的酰胺基团和精氨酸侧链与受体形成了重要的极性相互作用(图2a-c)。序列比对结果显示,PrRPR中与PrRP20的RF-酰胺基序所形成的极性网络及疏水口袋氨基酸残基高度保守(图2d),这表明RF-酰胺肽受体家族识别其配体的保守性特征。另外,PrRP20-PrRPR复合物结构相较于NPY1R的抑制态结构展现出了经典的A类GPCR激活特征,同时还伴有TM3胞外端的外移和TM6胞外端朝向TM5的位移(图2e-g)。研究团队进一步揭示了一种由Y3.37介导的不同于RF-酰胺肽受体和NPY受体家族的特殊激活机制(图2h,i)。阐明PrRP-PrRPR的配体识别和激活机制,不仅有利于为合理设计靶向这一重要肽-受体系统的选择性药物奠定基础,还可为理解RF-酰胺肽受体亚家族的配体识别和调控机制中的保守性与差异性提供参考,丰富了科研人员对GPCR激活机制的理解。
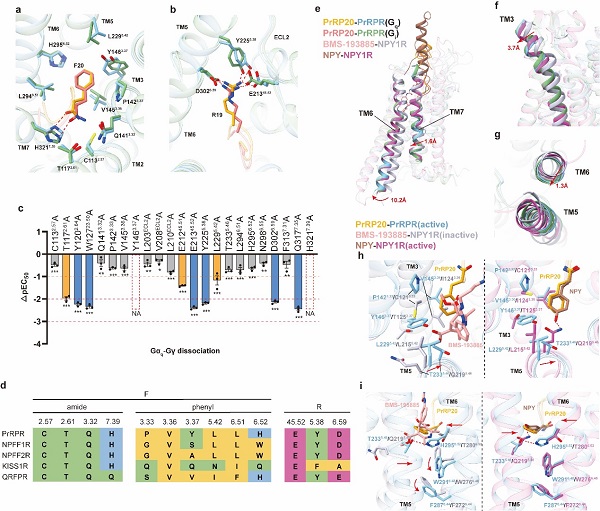
图2(a,b)RF-酰胺基序与受体的相互作用口袋。(c)功能实验数据验证配体结合口袋关键氨基酸对PrRPR激活的影响。(d)RF-酰胺肽受体的配体结合口袋残基保守性比较。(e-g)PrRP20-PrRPR复合物结构中的激活态构象变化。(h,i)Y1463.37残基所介导的“Toggle Switch”摆动。
上海药物所硕士研究生李阳和南京中医药大学博士研究生袁青宁为该论文的共同第一作者。上海交通大学医学院附属瑞金医院赵丽华研究员(原上海药物所徐华强课题组研究员)、上海药物所徐华强研究员为论文的共同通讯作者。本研究的冷冻电镜数据在上海市高峰电镜中心收集,中心吴凯、胡雯对样品制备和数据收集提供了大量帮助。该项研究工作得到了国家重点研发计划、上海市“科技创新行动计划”自然科学基金、国家自然科学基金委员会、上海市科学技术委员会、中国科学院青年创新促进会、中国科学院战略性先导科技专项(B类)和原创新药研究全国重点实验室等项目资助。
