脑科学与智能技术卓越创新中心杜久林组联合华山医院神经外科揭示颅内动脉瘤发病的分子机制
文章来源:脑科学与智能技术卓越创新中心 | 发布时间:2024-08-28 | 【打印】 【关闭】
2024年8月24日,《Cardiovascular Research》杂志在线发表了题为《Single-cell analysis reveals the implication of vascular endothelial cell-intrinsic ANGPT2 in human intracranial aneurysm》的研究论文。该研究由中国科学院脑科学与智能技术卓越创新中心(神经科学研究所)杜久林研究组和复旦大学附属华山医院神经外科朱巍团队完成,揭示了ANGPT2在颅内动脉瘤(IA)形成中的关键作用。
颅内动脉瘤是脑动脉中的局部膨出或球状扩张,影响约3.2%的人群,尤其在老年人群中患病率更高。其破裂可能导致动脉瘤性蛛网膜下腔出血,致死率高达27 - 44%。先前大量研究表明,血流紊乱、血管壁剪切应力、氧化应激、细胞外基质降解和炎症等外在因素可能参与了IA的形成和发展,但IA是否涉及血管内皮细胞(EC)自身内在分子通路仍不清楚。
为了深入探讨颅内动脉瘤的分子机制,研究团队对三例散发囊性IA患者样本和三例对照动脉样本进行了单细胞RNA测序,鉴定出包括内皮细胞在内的九大主要细胞群。通过差异表达基因、富集分析以及细胞通信分析,研究人员发现与血管生成相关的信号通路在内皮细胞中的异常增强,并确定了与IA形成相关的上调基因。
为了验证这些内皮细胞特异性候选基因的作用,研究团队使用斑马鱼作为模型,在内皮细胞中特异性逐个表达候选基因,观察是否出现类似IA表型的脑血管变化,发现angpt2a基因在引起IA样血管扩张和隆起中的关键作用。进一步地,研究人员通过基因敲入介导的pdgfrb基因破坏,建立了一种全新的IA遗传性动物模型,模拟了人IA的主要特征,并发现抑制angpt2a能够减轻IA模型中的血管扩张。
此项研究提供了单细胞转录组资源,揭示了人类颅内动脉瘤中内皮细胞的异质性,加速了IA发病机制背后主要分子机制的揭示。此外,研究团队建立了一种新型的IA遗传动物模型,为从分子和细胞水平长期研究IA的病理发生机制提供了新的工具。研究还确定了angpt2a在IA形成中的关键作用,提示通过靶向抑制ANGPT2对IA具有潜在的治疗价值。这些发现对于理解IA的分子基础及开发有效的治疗方法具有重要意义
中国科学院青促会会员李佳副研究员负责设计指导完成此项工作,与华山医院神经外科余果、张宏飞为本论文的第一作者,杜久林研究员与朱巍教授为本论文的通讯作者。杜久林组博士后訾化星、华山医院神经外科刘明剑亦做出重要贡献。研究获得了科技部国家重点研发计划、国家自然科学基金、上海市自然科学基金和中国科学院青促会的资助。
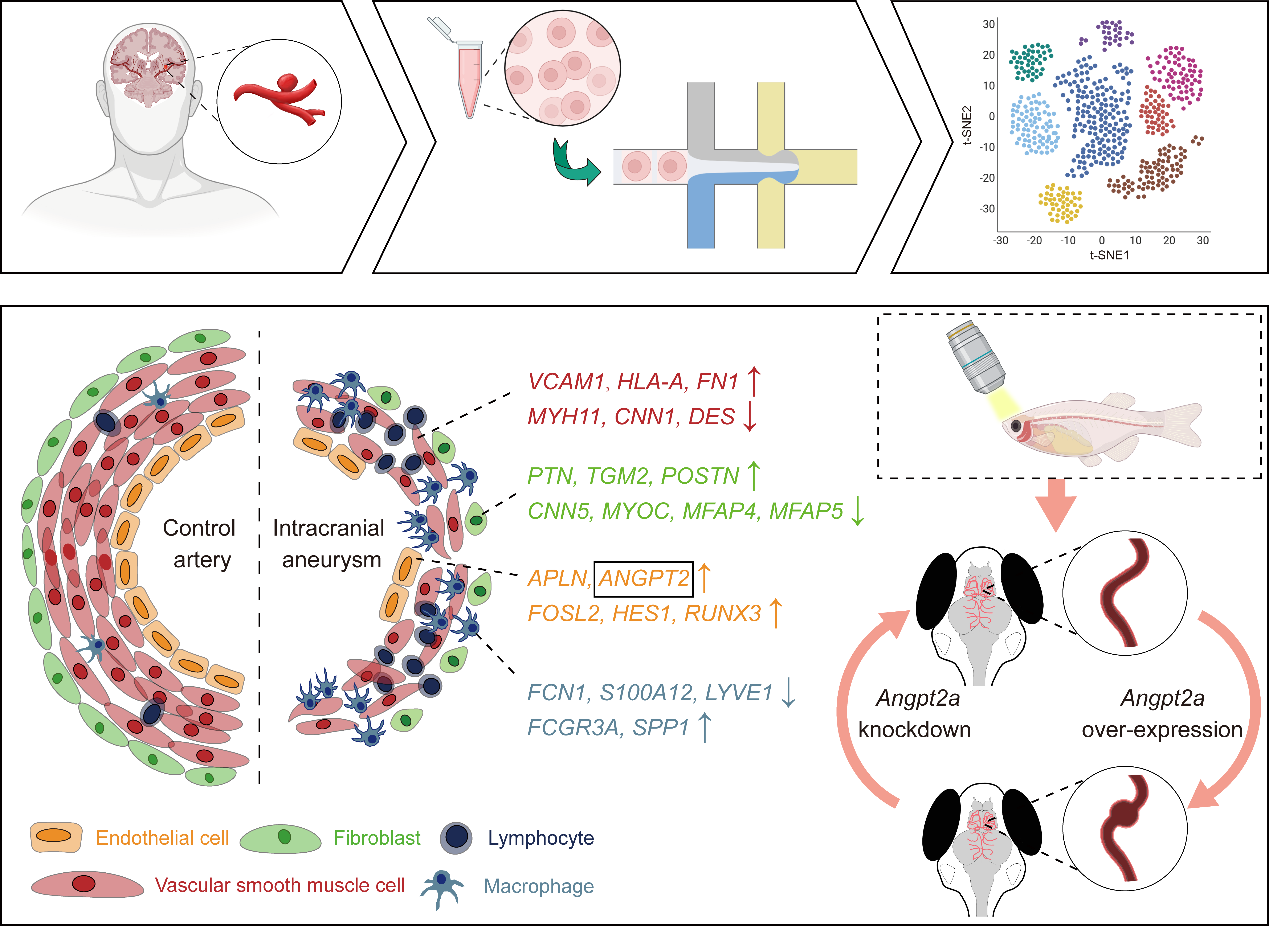
图注:上图显示从病人获取单细胞数据的流程。下图展示IA血管的分子表达变化特征,斑马鱼IA在体遗传模型的功能验证。
