上海有机所交叉中心提出化学分子识别病理蛋白聚集可塑性的新观点
文章来源:上海有机化学研究所 | 发布时间:2024-09-06 | 【打印】 【关闭】
淀粉样蛋白纤维的异常沉积是阿尔兹海默病、帕金森病、渐冻症等多种神经退行性疾病的核心病理标志物,也是实现这些疾病早期诊断和治疗的关键靶点。然而,有别于蛋白的天然构象,淀粉样蛋白聚集具有独特的结构多态性(structural polymorphism),即同一病理蛋白在不同条件下可能形成结构迥异的淀粉样聚集(amyloid polymorphs)。这些polymorphs具有不同的病理毒性,与不同的疾病亚型紧密相关,为开发特异性识别特定polymorph的化学小分子PET探针及抑制剂带来了挑战。
2024年8月22日,来自中国科学院上海有机化学研究所生物与化学交叉研究中心的刘聪课题组在《美国国家科学院院刊》(PNAS)期刊上发表了文章“Binding adaptability of chemical ligands to polymorphic α-synuclein amyloid fibrils”。该研究系统分析了不同化学小分子与帕金森病关键病理蛋白α-突触核蛋白(α-synuclein,α-syn)形成的不同amyloid polymorphs的结合位点与模式,首次揭示了小分子在识别与结合不同polymorphs时的高度可塑性。该工作是在刘聪课题组2023年提出的化学分子与淀粉样聚集互作的基本规律(https://www.nature.com/articles/s41589-023-01370-x)的基础上进一步深化的成果。这项工作进一步拓展和完善了化学分子与淀粉样聚集的互作理论,而且为病理蛋白聚集纤维的分子探针设计、研发以及其在临床应用中的潜力展现了新的前景。

在本项研究中,研究人员对七种不同骨架的小分子与携带E46K突变的α-syn淀粉样聚集的结合特性进行了深入分析,并将其与对野生型α-syn形成的polymorph 1a的结合特性进行了细致对比。利用表面等离子共振技术,研究人员测定了这些小分子对E46Kpolymorph的亲和力,并观察到它们对两种α-syn polymorphs 展现出相似的亲和力。进一步地,研究者人员采用冷冻电镜三维螺旋重构技术对小分子-E46K polymorph复合物进行了结构解析,揭示了小分子在不同polymorphs中的具体结合位点和结合模式。研究结果表明,与天然蛋白质的三维结合口袋相比,淀粉样聚集的二维管状结合界面空间限制较小,为小分子提供了更多的结合自由度。这一特点使得小分子能够通过不同的取向与不同的结合位点相互作用,从而实现了对不同amyloid polymorphs的识别和可塑性结合。
此外,研究还发现,通过改变小分子的骨架和官能团,可以对其结合可塑性进行精细调节。这一发现不仅丰富了我们对小分子与淀粉样蛋白聚集互作机制的认识,而且为设计具有高亲和力和高选择性的分子探针提供了重要的结构和化学基础。
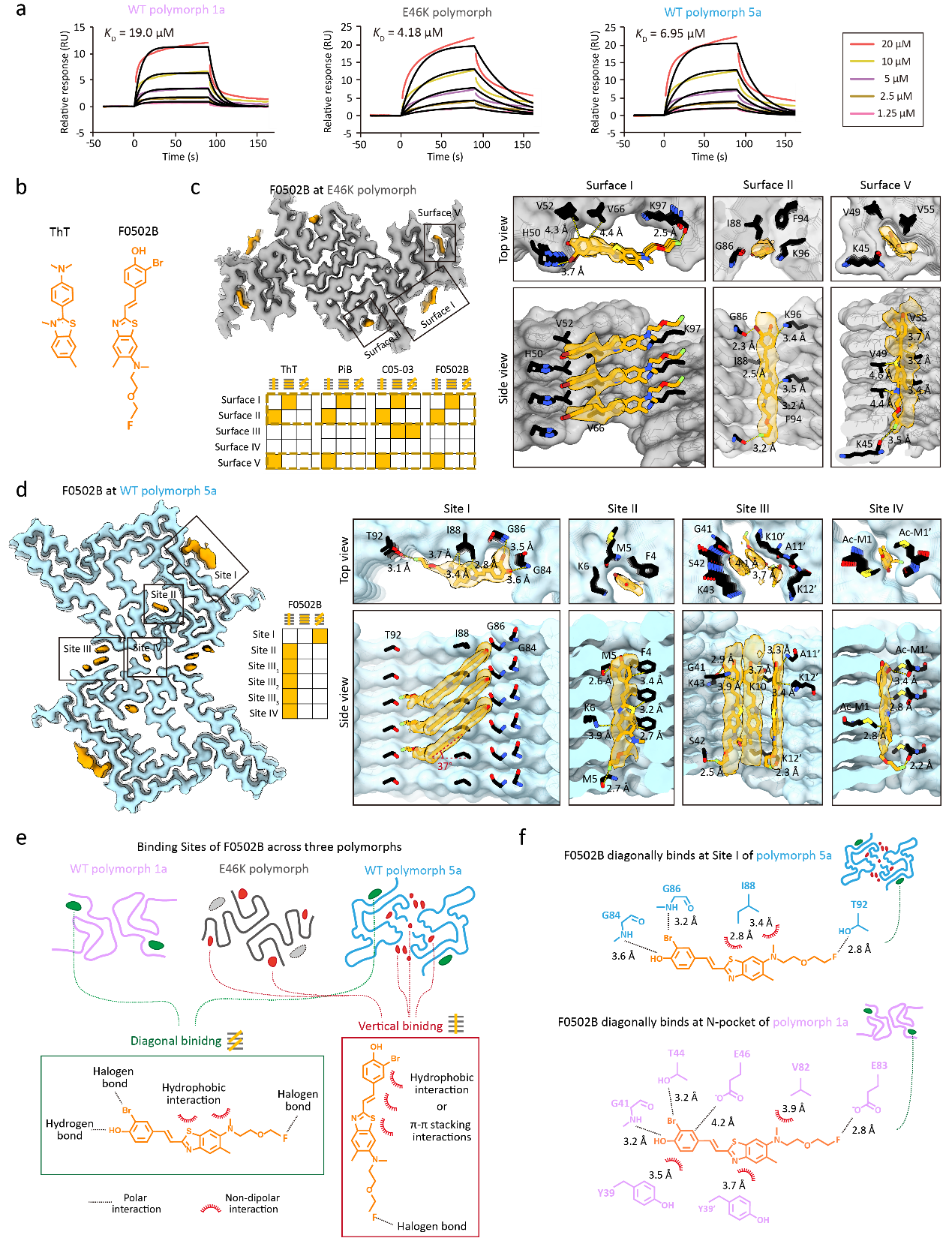
图1 F0502B的结合可塑性
(a)表面等离子共振技术分析F0502B与三种α-syn amyloid polymorphs的亲和力。(b)ThT与F0502B的化学结构。(c, d)F0502B与E46K polymorph(c)和WT polymorph 5a(d)的结合情况。分别展示了F0502B与两种polymorphs形成的复合物的冷冻电镜密度图、F0502B在两种polymorphs中的结合位点与结合模式的二维分析、以及F0502B在各个结合位点的放大图。(e)F0502B在不同polymorphs中的结合位点的总结与分类。(f)F0502B与WT polymorph 5a Site I (上)以及WT polymorph 1a N-pocket(下)的相互作用图谱。
综上,此项工作系统地研究了化学分子对病理蛋白聚集体不同polymorphs的结合特性,揭示了小分子在识别与结合不同polymorphs时的高度可塑性与适应性。本研究拓展了对小分子-淀粉样蛋白聚集体互作机制的理解,同时为淀粉样蛋白聚集特异性PET探针的开发带来了新的思考,为开发神经退行性疾病的精准分子诊断工具奠定了坚实的基础。
中国科学院上海有机化学研究所生物与化学交叉研究中心博士研究生刘凯恩和上海交通大学Bio-X研究院已毕业博士研究生陶友琦为该论文的共同第一作者。刘聪研究员为通讯作者。此项工作获得中国科学院上海有机化学研究所李昂课题组的大力支持。本项目受到国家自然基金委,中国科学院及上海市科委的基金支持。
原文链接:https://www.pnas.org/doi/10.1073/pnas.2321633121
