10月16日,国际心脏研究学会官方杂志Journal of Molecular and Cellular Cardiology在线发表了中国科学院上海营养与健康研究所杨黄恬研究团队题为“Human embryonic stem cell-derived cardiovascular progenitor cells stimulate cardiomyocyte cell cycle activity via activating the PI3K/Akt pathway”的研究论文。该研究揭示了人多能干细胞分化的心血管祖细胞激活成年心肌细胞增殖活性,为移植hCVPCs修复梗死心肌提供了可能的机制解释,并提示发育早期细胞的旁分泌物有可能成为促进成年心肌细胞年轻化的一种策略。
心肌梗死(心梗)后大量心肌细胞死亡,成年心肌细胞增殖能力极其微弱,死亡的心肌细胞被纤维疤痕所替代,进而导致心力衰竭(心衰)。因此,促进内源性心肌细胞增殖是阻止心梗后心肌病理性重构、改善心功能的重要治疗策略。基于人多能干细胞衍生心血管细胞的移植治疗研究揭示了其治疗缺血性心衰的应用前景。研究组既往开展的从小鼠到猪和非人灵长类心梗模型研究表明,移植人多能干细胞衍生的心血管前体细胞(hCVPCs)可以显著促进梗死心脏的功能恢复并限制纤维疤痕,旁分泌机制在其中起着重要作用,但对其作用机制的了解还非常有限,尤其对其影响受体心脏心肌细胞增殖和调控的机制更是知之甚少。
研究人员发现心肌注射hCVPCs在改善小鼠梗死心脏心功能和减少纤维疤痕的同时,可以诱导心肌细胞去分化并重新进入细胞周期。此外,已经失去增殖能力的成年大鼠心肌细胞经hCVPCs条件性培养基培养后也发生了去分化和细胞增殖,表明hCVPCs的分泌物激活了成年心肌细胞去分化和增殖活性。进一步机制研究发现,hCVPCs条件性培养基激活了PI3K/Akt信号通路,抑制PI3K/Akt信号通路则阻断hCVPCs诱导的心肌细胞增殖活性,并削弱了其修复梗死心脏的效果。
综上所述,该研究揭示了hCVPCs通过旁分泌作用激活PI3K/Akt信号通路,进而诱导成年心肌细胞去分化和增殖的作用,为移植hCVPCs修复梗死心肌提供了可能的机制解释,并提示发育早期细胞的旁分泌物有可能成为促进成年心肌细胞年轻化的一种策略。
中国科学院上海营养与健康研究所博士后陈忠炎、博士研究生虞修简和柯敏霞为该论文的共同第一作者,杨黄恬研究员为该论文通讯作者。该研究得到了中山大学中山医学院曹楠教授的支持、国家重点研发计划项目的资助以及中国科学院上海营养与健康研究所所级公共技术中心分析测试技术平台和实验动物技术平台的支持。
原文链接:
https://www.sciencedirect.com/science/article/pii/S0022282824001639?dgcid=author#f0005
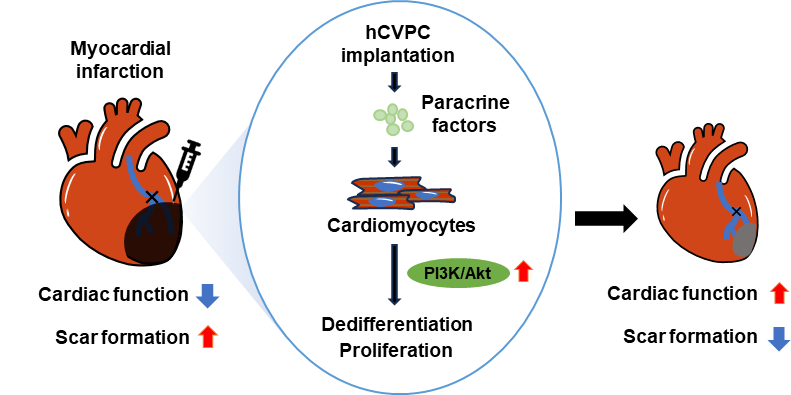
图:移植hCVPCs通过旁分泌作用促进心肌细胞增殖活性

