10月18日,国际学术期刊Advanced Science在线发表了中国科学院上海营养与健康研究所乐颖影团队题为“Glycerol Kinase Drives Hepatic de novo Lipogenesis and Triglyceride Synthesis in Nonalcoholic Fatty Liver by Activating SREBP-1c Transcription, Upregulating DGAT1/2 Expression, and Promoting Glycerol Metabolism”的研究论文。该研究揭示了肝脏甘油激酶在脂代谢稳态维持中的作用及其在非酒精性脂肪肝发生过程中促进肝细胞脂合成的分子机制,为非酒精性脂肪肝的防治提供了新靶标。
非酒精性脂肪肝(NAFL)是2型糖尿病和高脂血症等代谢紊乱疾病的风险因子,并可发展为非酒精性脂肪肝炎、肝硬化或肝细胞癌。探索NAFL的发病机制有助于寻找防治NAFL的新靶标。
肝脏脂肪酸从头合成和甘油三酯(TG)合成增加是NAFL患者肝脏脂质累积的重要原因。调控脂合成的转录因子固醇调节元件结合蛋白-1c(SREBP-1c)的表达升高是NAFL患者肝脏脂合成增加的重要因素,但其升高机制尚不完全清楚。甘油激酶(GK)通过催化甘油生成3-磷酸甘油参与TG合成,但GK是否参与NAFL的发生未见报道。
在高脂饮食(HFD)诱导的NAFL模型小鼠中,研究人员发现肝脏Gk的表达升高并且与肝脏TG含量、血清TG水平呈正相关。当NAFL小鼠敲减肝脏Gk后,肝脏Srebp-1c及其下游的脂肪酸合成和TG合成相关酶、以及TG合成相关酶Dgat1/2的表达都显著降低,肝脏脂质累积显著减轻,血清TG水平显著降低。此外,在HFD或高脂和高蔗糖饮食诱导的NAFL模型小鼠以及遗传性NAFL模型小鼠(ob/ob、db/db小鼠)中,发现肝脏Gk和Srebp-1c的表达显著增加,并且两者的升高呈正相关。这些结果提示GK升高可能通过SREBP-1c介导促进肝脏脂合成。进一步通过在小鼠肝脏以及离体培养的肝细胞过表达Gk、或在过表达Gk的同时敲减Srebp-1c或抑制脂肪酸合成相关酶,证实肝细胞GK表达升高通过上调SREBP-1c表达而促进脂合成相关酶表达,导致脂肪酸从头合成和TG合成增加。
研究人员探讨了HFD导致肝脏GK表达升高的机制。发现在HFD诱导NAFL的过程中,血液胆固醇和游离脂肪酸的升高早于肝脏GK表达的升高。胆固醇和脂肪酸能促进肝细胞表达GK;脂肪酸通过上调ERG1表达而促进GK表达。这些结果提示胆固醇和脂肪酸是HFD引起肝脏GK表达升高的重要因素。
研究人员进一步探讨了小鼠GK调控Srebp-1c表达的分子机制。发现GK通过直接与Srebp-1c基因的启动子区域结合促进Srebp-1c基因转录,并且还通过与SREBP-1c蛋白结合,促进SREBP-1c对自身基因转录的正反馈调控。此外,还发现人的GK也通过以上途径调控SREBP-1c基因表达。GK与SREBP-1c的结合部位不局限于GK的某一区域,GK对SREBP-1c基因的转录调控不依赖其酶活性。
最后,研究人员探讨了肝脏GK在生理性脂稳态维持中的作用。发现在生理状态下,GK通过调控甘油代谢在TG合成及脂稳态维持中发挥重要作用,其作用不依赖于对Srebp-1c基因表达的调控。
综上,该研究发现在生理情况下,肝脏GK通过调控甘油代谢参与TG合成,在脂稳态维持中发挥重要作用。在高脂饮食时,血液中胆固醇和游离脂肪酸水平的升高促进肝细胞表达GK,GK升高不仅通过促进甘油代谢增加TG合成,还通过促进SREBP-1c基因转录,进而促进脂合成相关酶表达,使脂肪酸和TG合成增加,导致肝脏脂质积累和血液TG升高。该研究不仅揭示了GK调控肝脏脂质代谢的新机制及其在饮食导致的NAFL发生中的作用,而且为NAFL的防治提供了新靶标。
中国科学院上海营养与健康研究所博士生欧阳舒毓为该论文第一作者,乐颖影研究员为该论文通讯作者。该研究得到了中国科学院上海营养与健康研究所李于研究员、应浩研究员等的大力支持,以及所级公共技术中心分析测试技术平台、高分辨质谱技术系统、实验动物技术平台的支持。该研究获得国家自然科学基金项目资助。
原文链接:https://pubmed.ncbi.nlm.nih.gov/39418169/
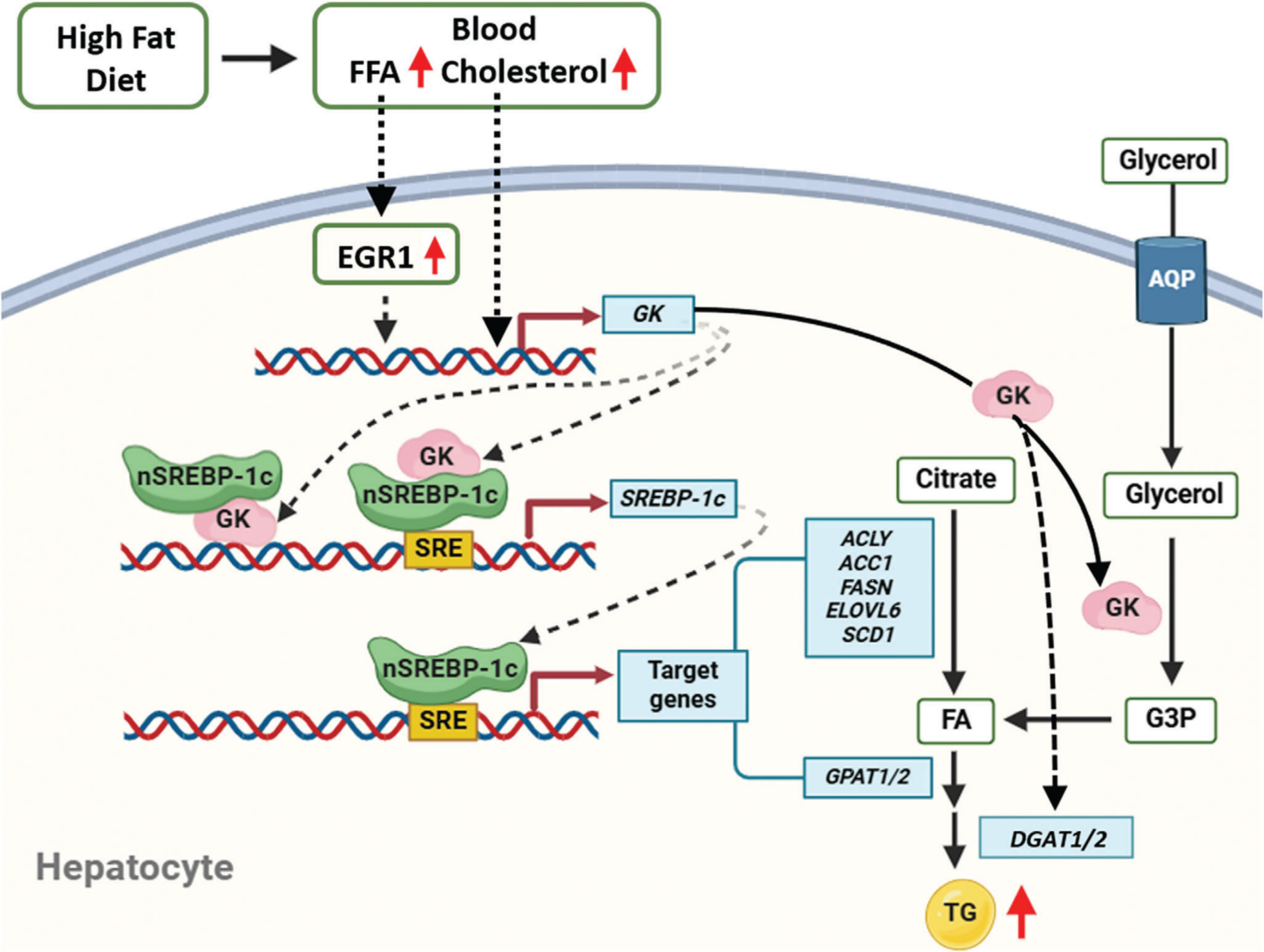
图:高脂饮食诱导脂肪肝的过程中GK促进肝细胞脂质累积的模式图

