2024年12月13日,中国科学院上海药物研究所徐华强团队在PNAS上发表了题为“Molecular basis of lipid and ligand regulation of prostaglandin receptor DP2”的在线文章。在该研究中,团队利用冷冻电子显微镜(cryo-EM)技术,解析了三种DP2-Gi复合物的结构,揭示了PGD2与吲哚美辛在DP2上的不同结合模式,为理解受体激活和信号转导提供了关键见解。
前列腺素是通过环氧合酶(COX)途径合成的生物活性脂质,在炎症、免疫反应和多种细胞过程中发挥着重要作用。它们通过与特定的脂质G蛋白偶联受体相互作用,诱发多种生物功能,包括前列腺素D2受体DP1和DP2、前列环素受体IP、前列腺素E2受体EP1至EP4、前列腺素F2α受体FP以及血栓素受体TP。前列腺素D2(PGD2)主要在中枢神经系统和免疫系统中产生,并在睡眠调节和炎症反应中发挥重要作用。DP2,也被称为T辅助细胞2型表达的趋化因子受体同源分子(CRTH2),在过敏性疾病中尤为重要。尽管DP2与其他前列腺素受体的序列同源性较低,但它与趋化因子受体的关系密切,主要在T辅助细胞2型、嗜酸性粒细胞等免疫细胞中表达。DP2受体通过与Gi亚型G蛋白偶联,调节cAMP和Ca2+的水平,并能与β-arrestin蛋白相互作用。
本项研究中,研究团队发现,PGD2主要通过Gαi信号通路激活DP2,而吲哚美辛则倾向于通过β-arrestin蛋白信号通路进行激活 (图1A-C)。利用冷冻电子显微镜(cryo-EM)技术,团队成功解析了三种DP2-Gi复合物的结构,包括未结合配体的DP2-Gi复合物、结合内源性配体PGD2的复合物,以及结合吲哚美辛的复合物(图1D-F)。这些结构揭示了PGD2与吲哚美辛在DP2上的不同结合模式,为理解受体激活和信号转导提供了关键见解(图1G)。通过结构分析结合功能实验,研究深入探讨了这两种分子独特的受体激活机制,并揭示了吲哚美辛偏向性激活β-逮捕蛋白的分子机制(图1H-J)。
此外,研究还发现了一个新的磷脂结合位点,该位点位于DP2与G蛋白的交互界面。结合质谱分析、G蛋白招募实验、AlphaScreen结合力测定以及分子动力学模拟,研究表明该磷脂类在调节DP2信号转导中发挥了重要作用 (图1K-N)。这一发现不仅丰富了对DP2功能的理解,也为未来的药物开发提供了新的思路。
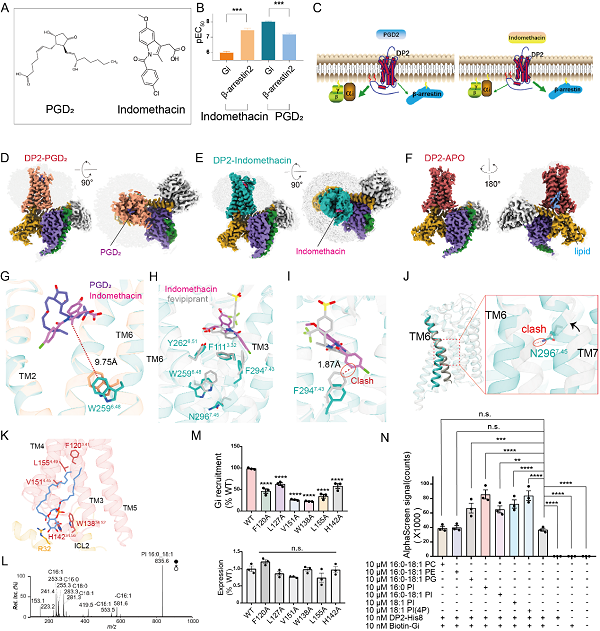
图1. (A) 吲哚美辛和PGD2的化学结构。(B) 吲哚美辛和PGD2对DP2激活的pEC50值。(C) 人DP2受体信号偏向的示意图。(D, E, F) PGD2-DP2-Gi复合物、吲哚美辛-DP2-Gi复合物和DP2-Gi复合物的冷冻电镜密度图。(G) PGD2、吲哚美辛和W2596.48之间的距离测量。(H) 吲哚美辛、fevipiprant及参与受体激活的关键残基的位置。(I) 吲哚美辛结合的DP2中吲哚美辛与非活性DP2中F2947.43之间的冲突。(J) 吲哚美辛结合的DP2与非活性DP2的叠加,二者在TM6和TM7的中点对齐;突出显示了吲哚美辛结合的DP2中的N296与非活性DP2中TM6骨架之间的冲突。(K) DP2-Gi与16:0-18:1 PI之间的相互作用界面;残基以棒状表示。(L) 质谱分析结果。(M) 野生型DP2与突变体之间Gi招募效率的比较。(N) AlphaScreen相互作用测定结果,显示在不同磷脂存在下,10 nM纯化的生物素-Gi与10 nM H8标记的DP2蛋白的招募。
该团队此前已报道前列腺素F2α(Nature Communications, 2023)和前列环素受体(Science Advances, 2024)的结构药理学机制,当前研究是在前列腺素受体结构药理学领域的又一重要突破。研究团队希望通过进一步探索,推动DP2相关药物的临床应用,为过敏性疾病患者带来新的治疗选择。随着对DP2机制的深入了解,科学家们期待能够设计出更具针对性和安全性的抗过敏性哮喘药物,从而改善患者的生活质量。
本研究中的冷冻电镜数据在上海市高峰电镜中心收集。上海科技大学徐久银、上海药物所的徐有伟副研究员、南京中医药大学的博士生侯丽和上海药物所博士生何欣恒为该论文的共同第一作者;上海药物所徐华强研究员和吴灿荣副研究员为共同通讯作者。上海药物所为本研究的第一完成单位。清华大学瑕瑜教授和临港实验室蒋轶研究员对此研究做出了重要贡献。该工作获得了国家自然科学基金委、科技部、中国科学院先导专项以及上海市市级科技重大专项等项目的资助。
全文链接:https://www.pnas.org/doi/10.1073/pnas.2403304121
(供稿部门:徐华强课题组)

