氢甲酰化反应以烯烃、氢气和一氧化碳为原料在过渡金属催化下以完美的原子经济性转化为醛,在有机合成和精细化工领域具有广泛的应用。通过探索金属铑/手性膦配体催化体系发展高效的不对称氢甲酰化反应,实现手性药物或精细化学品的快速合成近年来备受关注,但进展仍然有限。总而言之,单取代和1,2-二取代烯烃的不对称氢甲酰化研究较多,反应活性和立体选择性控制问题已基本解决;1,1-二取代和三取代烯烃的不对称氢甲酰化反应仍很有限,反应活性和手性控制仍是挑战;而四取代烯烃的不对称氢甲酰化反应非常罕见(图1)。
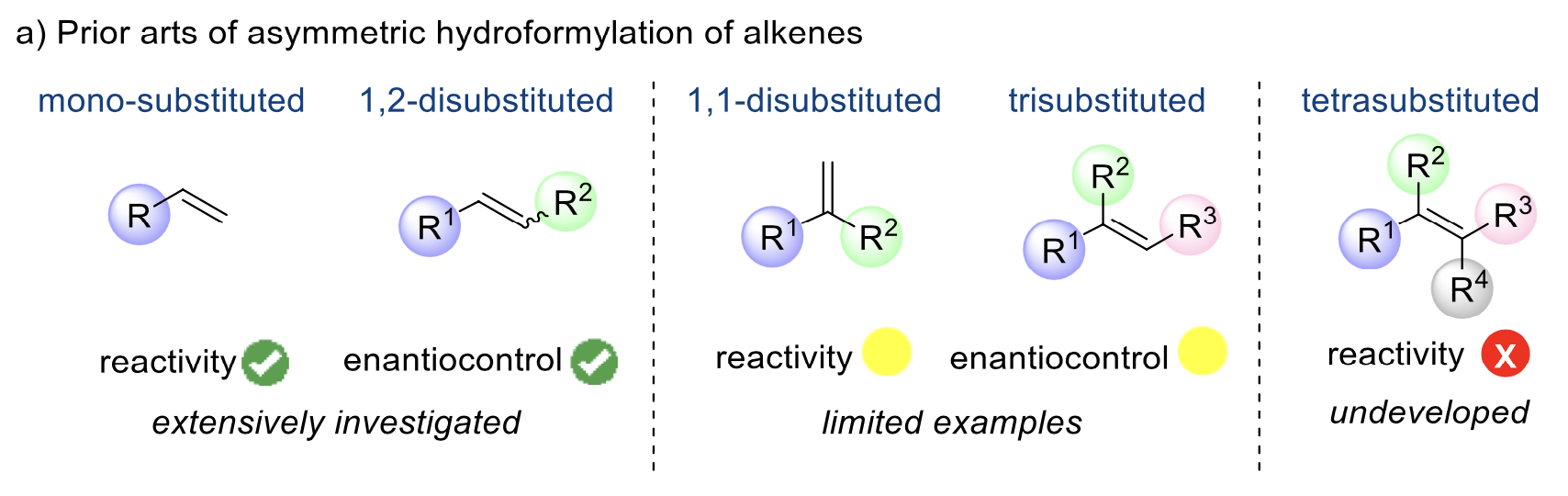
图1 各类取代烯烃不对称氢甲酰化反应的研究现状
近日,中国科学院上海有机化学研究所汤文军课题组和薛小松课题组合作在1,1-二取代烯烃的不对称氢甲酰化反应研究中取得进展。研究团队采用汤文军课题组开发的特色手性双膦配体TFPNH-BIBOP,首次实现了α-取代烯酰胺的铑催化不对称还原氢甲酰化反应,高对映选择性和区域专一性地构建了一系列手性γ-氨基醇,拓宽了不对称氢甲酰化反应的底物适用范围。实验结果和理论计算揭示配体与底物间的氢键相互作用有效促进该催化反应的活性和高对映选择性。(J. Am. Chem. Soc. DOI: 10.1021/jacs.4c13770,图2)
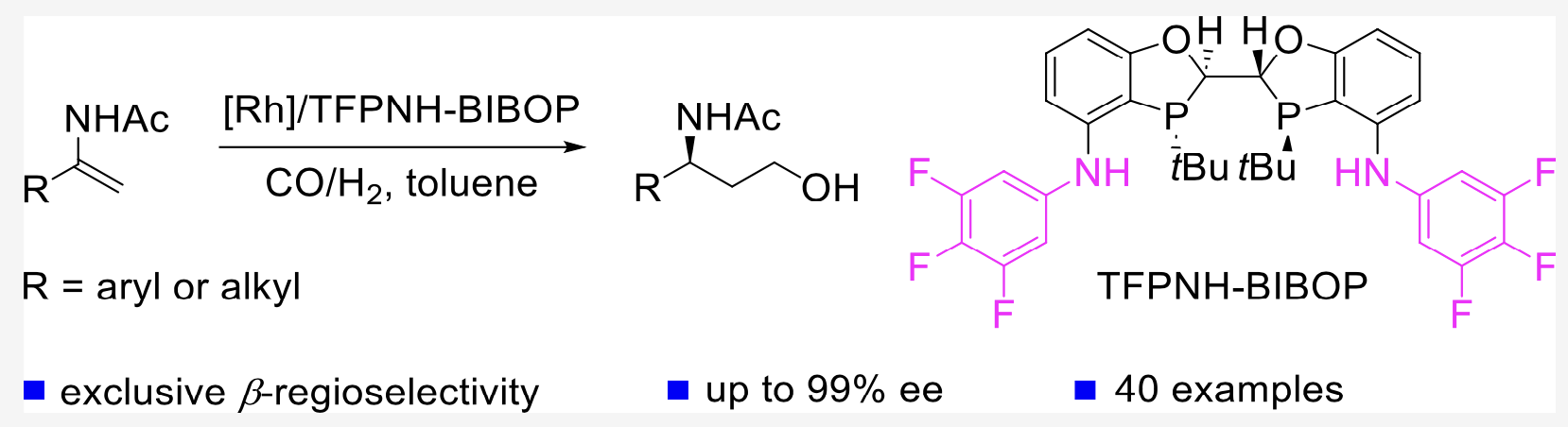
图2 α-取代烯酰胺的铑催化不对称还原氢甲酰化反应研究新进展
团队基于在发展P-手性膦配体及不对称氢化领域的研究经验 (Acc. Chem. Res.2019, 52, 1101−1112),挑战N-(1-苯基-乙烯基)-乙酰胺的不对称氢甲酰化反应。不出意外,极大部分商业化手性配体表现出没有活性或很低的产率。当采用4,4'-芳胺基取代的手性BIBOP配体时,产率和立体选择性有大幅度提高。进一步研究表明,具有吸电子取代基的4,4'-芳胺基取代的BIBOP配体有助于反应活性和立体选择性。当采用TFPNH-BIBOP为配体时,不对称还原氢甲酰化产物的产率达80%,立体选择性达96%ee。该反应适合具有不同位点、不同电性取代基的α-苯基烯酰胺,并兼容并环和杂环的底物结构,高对映选择性地合成一系列手性γ-氨基醇。值得注意的是,该催化体系也适用于烷基烯酰胺,同样表现出高对映选择性。采用该不对称还原氢甲酰化反应,团队仅用两步构建了抗艾滋病药物Maraviroc的手性中间体,展示了该方法的应用潜力和价值。理论计算表明,底物烯酰胺的羰基与手性配体中的N-H间的氢键相互作用干预了烯烃插入这个手性决定步骤,而配体中氟取代基的引入有效促进氢键相互作用,这些因素催生了高对映选择性的不对称还原氢甲酰化反应(图3)。
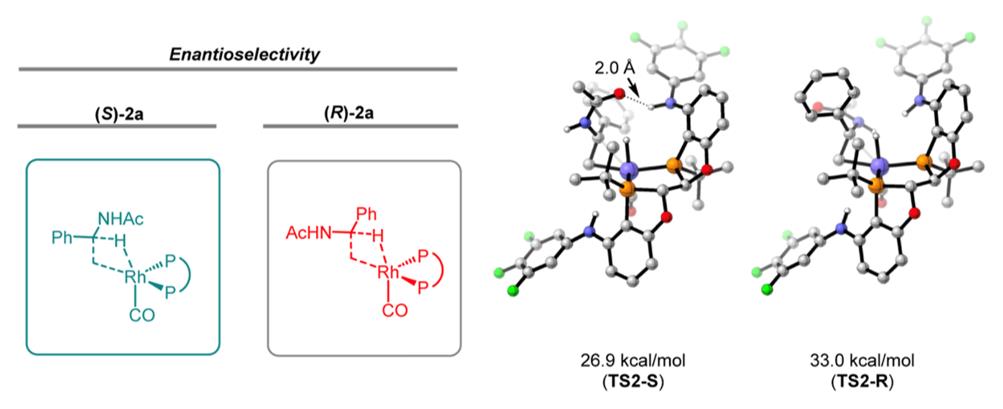
图3 手性决定步骤的理论计算结果
该工作发展的一系列4,4'-芳胺基取代的手性BIBOP配体有效促进了α-取代烯酰胺的铑催化不对称还原氢甲酰化反应,并为手性1,3-氨基醇结构的高效构建提供了新策略;原创性膦配体结构的发展以及配体和底物之间相互作用对催化效率的影响为构建更高效的催化体系、进一步拓宽不对称氢甲酰化反应具有指导意义。上海有机所博士生朱雨欣和博士后张宇辰是该论文的共同第一作者,杨贺副研究员、薛小松研究员和汤文军研究员是共同通讯作者,该研究工作得到了国家自然科学基金委和科技部的资助。

