2024年11月19日,中国科学院上海药物研究所李佳团队、周宇波团队、谭敏佳团队及海军军医大学第一附属医院血液内科杨建民团队在Science Bulletin上在线发表了题为“Integrative proteogenomic and pharmacological landscape of acute myeloid leukaemia”的研究论文,对 101名中国急性髓系白血病(简称AML)患者来源的样本进行了全面的基因组学、蛋白质组学和磷酸化蛋白质组学分析,并基于77种药物(包含AML临床常用药、激酶抑制剂、表观遗传相关抑制剂),对样本进行了系统性体外药物敏感性分析。基于蛋白质组的无监督聚类揭示了三种具有不同分子特征和临床结果的亚型。结合蛋白质组学/磷酸化蛋白质组学数据对药物敏感性进行进一步的综合分析,发现了潜在的药物组合(图1),促进了对AML分子特征与药敏相关性机制的理解。
AML是高异质性血液恶性肿瘤,以骨髓髓系细胞增多和成熟细胞减少为特征,占白血病的28%,五年生存率仅为31.7%。AML患者的一线治疗是以蒽环类药物和阿糖胞苷为主的诱导化疗。近年,分子靶向药物,如FLT3、BCL2抑制剂和CD33抗体获批治疗AML。但目前的疗法仍面临临床响应率低、易复发耐受等艰巨挑战。
目前已有多项研究(TCGA、BeatAML等)使用基因组测序、蛋白质定量等组学技术收集并建立了AML的多组学数据库,这些研究为AML突变的分布和频率、亚克隆结构、疾病过程中的克隆进化以及疾病的表观遗传景观提供了前所未有的视角,也为临床提供了更多的潜在治疗靶点与治疗方案。然而,目前仍然缺乏更全面的多组学特征与药物敏感性相结合的研究。
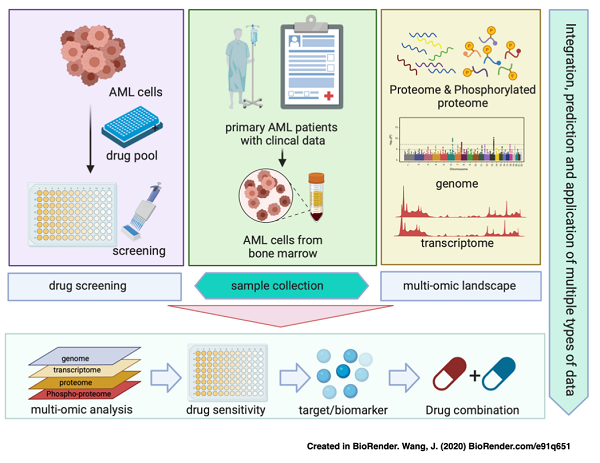
图1 AML多组学数据库和药敏分析平台的建立流程
本研究基于无监督聚类和AML的蛋白质组学数据将AML样本分为了三类亚型(图2),尽管三类亚型没有显著的预后差异,但是S-I型的患者在诱导化疗后可测量残留病灶(MRD)较高,反映出其治疗后清除效率较低,疗效较差。结合临床数据进一步分析该研究发现,异基因造血干细胞移植(Allo-SCT)并未延长S-I型患者的生存期(对数秩检验,P > 0.05)。然而,S-II&III型患者明显受益于Allo-SCT。这些结果表明Allo-SCT可能是S-II&III亚型的潜在治疗策略。
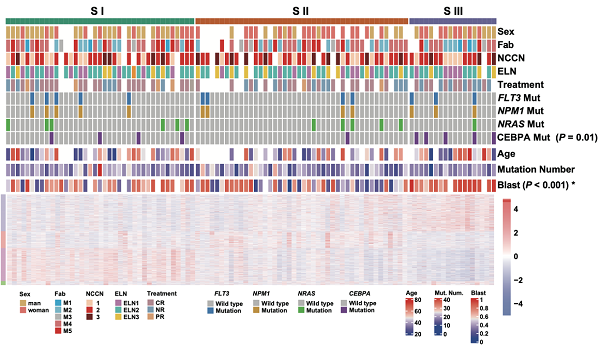
图2 AML蛋白质组学分型与临床特征的相关性
为了进一步了解药物敏感性和AML分子特征之间的相关性,该研究对56名患者样本中的原代AML细胞进行了体外药敏测试,基于两轮高通量筛选(2247类化合物初筛、285类化合物复筛),最终选定77种化合物进行多浓度点测试,这些化合物包含已经上市的AML药物、处于临床阶段的抗AML化合物以及尚未应用于AML治疗的化合物(图3)。
通过联合分析蛋白质组学、磷酸化蛋白质组学与体外药敏数据,该研究发现ALDH3A2蛋白表达水平与阿糖胞苷耐药程度呈显著正相关,进一步该研究联用ALDH3A2抑制剂双硫仑和阿糖胞苷治疗10种AML细胞系,并观察到双硫仑可以增强大多数细胞系中阿糖胞苷的治疗效果。此外,该研究发现PDK激酶下游通路活性与Acalisib(PI3K抑制剂)耐药正相关。通过使用PDK1抑制剂GSK2334470可以提高Acalisib和另一种PI3K抑制剂GDC0032的抗AML作用。
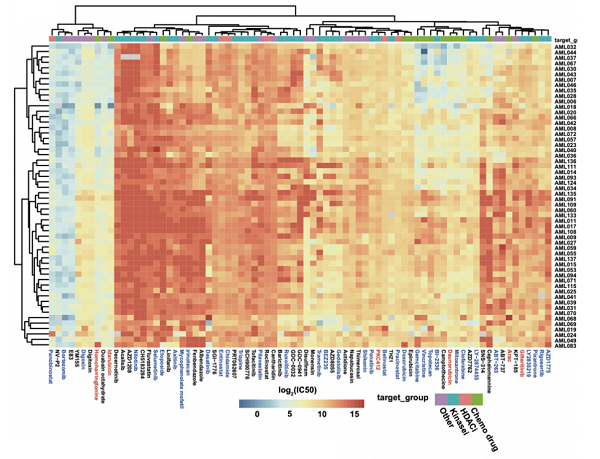
图3 56例AML患者样本中77种化合物的药敏数据热图。已批准用于AML治疗的药物标记为红色,处于临床阶段的药物标记为蓝色。
综上,该研究提供了中国人群的首个基因组、转录组、蛋白质组、磷酸化蛋白质组与体外药敏数据的AML组学全景数据库,并整合分析了AML的分子特征与临床结果,基于体外药敏数据揭示了多类耐药相关标志物,并为AML提供了潜在的诊断和治疗策略。
上海药物所副研究员汪翰林、中科中山药物创新研究院徐骏宇研究员、海军军医大学第一附属医院王桃主治医师、上海药物所与南京中医药大学联合培养博士生徐高亚为该文共同第一作者。上海药物所李佳研究员、周宇波研究员、谭敏佳研究员和海军军医大学第一附属医院杨建民教授为该论文的共同通讯作者。该项研究获得了国家自然科学基金、中国青年人才托举工程、广东省高水平新型研发机构、广东省高水平创新研究院、上海市市级科技重大专项、上海市启明星计划、上海市启明星计划扬帆专项、山东省实验室、泰山学者等项目资助。
全文链接:https://www.sciencedirect.com/science/article/pii/S2095927324008260?via=ihub#gp020
(供稿部门:李佳课题组)

