干旱、盐胁迫以及低温等非生物胁迫引起的渗透胁迫严重影响植物的存活,造成作物生产巨大损失,危害粮食生产安全。渗透胁迫是一种物理刺激,它在细胞水平上触发多种生理变化,包括膨压、细胞壁完整性、膜张力和细胞体积的变化。植物可能感知这些生理变化并触发下游反应,这导致渗透胁迫信号的解析较为困难。
非胁迫条件下,SnRK2被PP2C蛋白磷酸酶抑制;渗透胁迫下,核心蛋白激酶SnRK2被快速激活。在ABA信号中,第III亚组SnRK2s(SnRK2.2/3/6)的释放依赖于ABA受体PYL与负调控因子PP2C的结合。然而,第I亚组SnRK2s(SnRK2.1/4/5/9/10)不响应ABA,且渗透信号如何介导其解抑制过程还不清楚。对渗透胁迫下SnRK2解抑制机制的研究,有助于深入解析渗透信号的感知和传导过程,为植物抗逆研究提供新的方向。
2025年1月30日,中国科学院分子植物科学卓越创新中心、植物高效碳汇重点实验室(中国科学院)赵杨研究组于国际学术期刊Science Advances在线发表题为“SnRK2 kinases sense molecular crowding and form condensates to disrupt ABI1 inhibition”的研究论文。该研究揭示了第I亚组SnRK2激酶感知高渗引起的大分子聚集,并通过相分离引起的空间阻隔解除PP2C对SnRK2的抑制。
非胁迫条件下生长的拟南芥幼苗,其等渗点近似于300 mM甘露醇溶液。利用snrk2高阶突变体,该研究首先发现,300 mM甘露醇溶液处理后,第III亚组SnRK2可以被激活,然而第I亚组SnRK2不能被激活;当用600 mM的甘露醇溶液处理,则可以同时激活这两个亚组SnRK2。研究人员构建了所有SnRK2的标签融合转基因材料,证明第I亚组SnRK2特异性地被高于等渗点的严重的高渗胁迫激活,而第III亚组SnRK2则可以响应ABA、温和以及严重的渗透胁迫。这些结果说明不同亚组SnRK2响应的胁迫信号有差异,其抑制解除机制不同。
高于等渗点的高渗胁迫造成质壁分离,导致细胞质体积快速下降,引起大分子聚集。研究人员发现第I亚组SnRK2感知高渗胁迫导致的大分子聚集信号,形成凝聚体。该过程是可逆的,当恢复正常的低渗环境时SnRK2凝聚体会消除。第I亚组SnRK2具有IDR结构域,且具有相分离能力;IDR缺失的SnRK2不能响应高渗发生相分离,也不能被高渗激活。然而,激酶活性丧失的SnRK2突变体,仍能感知高渗胁迫导致的大分子聚集信号,形成凝聚体。这些结果说明第I亚组SnRK2的相分离是其响应高渗激活的先决条件。
SnRK2的激活需要首先解除其被抑制状态。研究发现ABI1是第I亚组SnRK2的一个重要的负调控因子。非胁迫条件下,ABI1与SnRK2均匀分布于细胞质中,SnRK2被ABI1抑制;高渗胁迫下,共定位分析显示第I亚组SnRK2相分离形成凝聚体,而ABI1不能相分离,使得SnRK2和ABI1之间产生空间阻隔,从而介导PP2C对SnRK2的抑制解除过程。
第I亚组SnRK2在种子植物中进化而来。通过对SnRK2不同组合的突变体以及第I亚组SnRK2的回补材料进行表型分析,发现第I亚组SnRK2对于盐胁迫下的种子萌发起着核心作用,具有作物种子抗逆改良的潜在应用意义。
综上所述,高渗胁迫下第I亚组SnRK2感知大分子聚集信号,发生相分离形成凝聚体,使得与负调控因子ABI1形成空间阻隔,从而释放SnRK2(图1)。该研究结果揭示了一种独特的相分离介导的蛋白激酶抑制解除机制,阐明了一条渗透信号感知介导核心激酶激活的主效渗透感应机制。
此外,该研究组近期报道渗透信号通过BIK1介导的酪氨酸磷酸化修饰,解除PP2C对第III亚组SnRK2的抑制(EMBO Journal,2024),还发现Ca2+依赖性蛋白激酶CPK3/4/6/11/27,响应渗透激发的Ca2+信号介导SnRK2的激活(Developmental Cell, 2025)。从而提出了激酶激活的两步机制:解抑制和激活(图2)。
中国科学院分子植物科学卓越创新中心博士生袁仙平为该论文第一作者,赵杨研究员为通讯作者。该项研究得到中国科学院基础与交叉前沿科研先导专项、中国科学院基础研究领域青年团队稳定支持项目、上海市科学技术委员会、中国科学院分子植物科学卓越创新中心植物高效碳汇重点实验室和逆境生物学研究中心的资助。
论文链接DOI: 10.1126/sciadv.adr8250
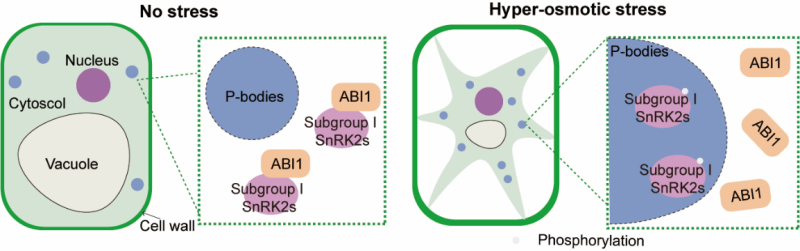
图1:第I亚组SnRK2激酶感知渗透信号形成凝聚体解除ABI1抑制
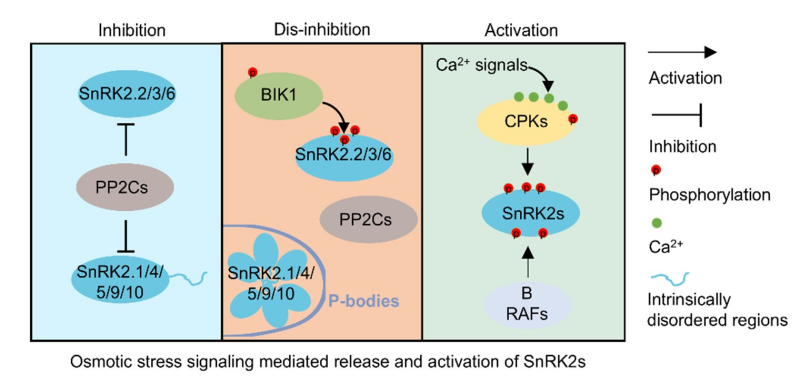
图2:渗透胁迫下SnRK2的激活机制:1)解抑制;2)激活

