中国科学院分子植物科学卓越创新中心Chanhong Kim研究团队以突破性报告(Breakthrough Report)形式在国际权威期刊The Plant Cell上发表题为"Temperature-driven changes in membrane fluidity differentially impact FILAMENTATION TEMPERATURE-SENSITIVE H2-mediated photosystem II repair"的研究成果,揭示了不同冷、热胁迫下膜流动性变化对叶绿体蛋白稳态机制的影响。
光合作用作为地球生命活动的基础过程,在能量转换过程中不可避免地产生有害副产物——活性氧(ROS)。这些活性氧不仅会破坏脂质膜结构,还会损伤膜整合蛋白,尤其是光系统II(PSII)核心蛋白,从而显著影响光合作用效率和植物生产力。因此,在环境条件波动下,PSII蛋白的及时修复对于维持光合系统稳态具有关键作用。
本研究成功阐明了植物生物学领域长期悬而未决的科学问题:为何缺乏FtsH2蛋白酶的var2突变体在PSII修复过程中表现出对低温敏感而对高温不敏感的特性,尽管在两种温度条件下都会产生活性氧并导致PSII光损伤。研究首次揭示了膜流动性在不同温度条件下对PSII修复过程的调控作用,并阐明了该过程的热力学特征。
本研究通过对var2背景下分别表达底物提取缺陷和蛋白水解缺陷的FtsH2, 发现在冷胁迫条件下膜流动性的降低需要FtsH2与其他FtsH组分构成的异源六聚体复合物增强底物提取能力而不是蛋白酶降解能力。因此,过表达底物提取活性缺陷型FtsH2 (FtsH2G267D) 无法回补var2的冷敏感的表型。与之相反,蛋白酶活性缺陷型FtsH2 (FtsH2H488L)则完全回补了var2的冷敏感表型,这提示在冷胁迫下膜的流动性降低时,与FtsH2底物提取相关的 AAA-ATPase活性至关重要。而在较高温度下,由于膜的流动性得以升高,使得来自FtsH复合体中其他FtsH组分的AAA-ATPase活性足以满足底物的提取,这也解释了为什么var2在热胁迫下与野生型具有类似的适应能力(图1)。
综上所述,本研究在PSII修复机制及膜状态对膜蛋白稳态影响方面取得了重要理论突破。这些发现不仅为叶绿体功能和胁迫适应研究开辟了新方向,深化了对温度胁迫影响植物生物学过程的认识,更为相关应用研究奠定了坚实的理论基础。
中国科学院分子植物科学卓越创新中心博士研究生张景志为论文第一作者,Chanhong Kim研究员为通讯作者。该研究得到了中国科学院分子植物科学卓越创新中心、中国科学院以及国家自然科学基金的支持。
论文链接:https://doi.org/10.1093/plcell/koae323
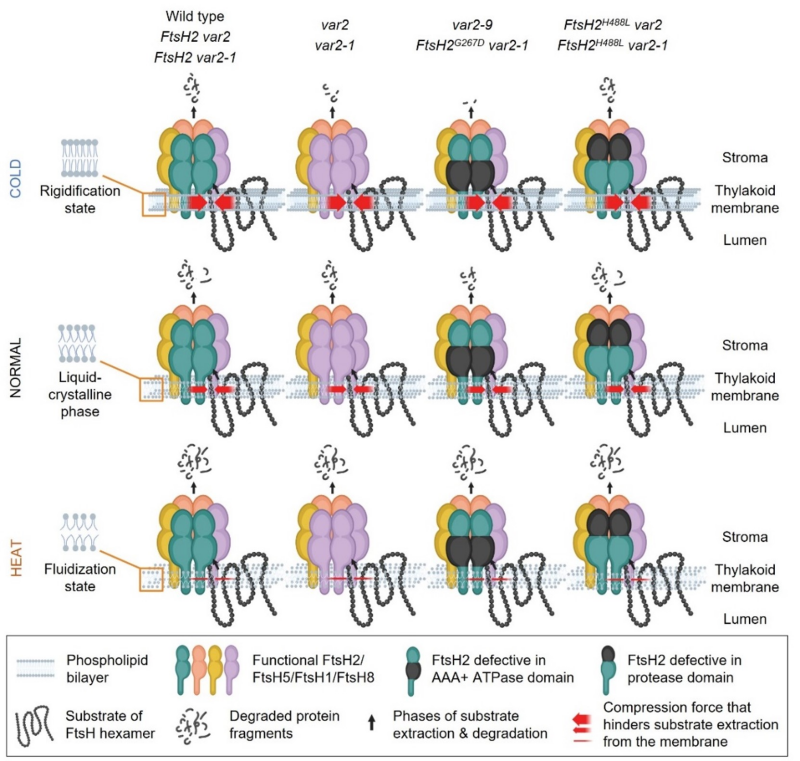
图1. 不同温度下膜的流动性变化对不同基因型的PSII修复影响的工作模型示意图。

