帕金森病(Parkinson's Disease, PD)是一种进展性神经退行性疾病,主要影响中脑多巴胺神经元,导致运动和非运动症状,如肌肉僵直、震颤、运动迟缓以及认知障碍等。随着全球人口老龄化,PD患者数量将持续增加。目前PD的治疗主要依赖多巴胺替代疗法,如左旋多巴(L-dopa),这种治疗虽然可以暂时缓解症状,但无法阻止病情进展或改善所有类型的症状。因此,深入探究PD复杂的致病机制,并发现新的治疗靶点,以开发更有效的治疗策略,是PD治疗研究的核心方向。
近期,中国科学院上海有机化学研究所生物与化学交叉研究中心、生命过程小分子调控全国重点实验室刘聪团队与复旦大学附属华山医院郁金泰团队以及复旦大学脑科学转化研究院袁鹏团队合作在Science杂志发表题为 “Neuronal FAM171A2 mediates α-synuclein fibril uptake and drives Parkinson’s disease” 的最新研究成果。该研究鉴定出介导神经元摄取PD病理蛋白α-syn淀粉样纤维的神经元膜受体蛋白FAM171A2,并筛选获得具有阻断α-syn淀粉样纤维与受体结合的小分子化合物,本研究提供了全新的治疗PD的潜在靶点,为PD药物研发提供了新的可能。
 、
、
首先,通过大规模的全基因组关联研究,研究人员发现FAM171A2的多个突变体与PD风险显著相关。此外,FAM171A2蛋白在PD患者的脑脊液和大脑组织中的表达量均高于正常对照组,FAM171A2蛋白水平与PD的多个神经病理标志物具有显著的病理相关性。因此,FAM171A2作为PD的风险基因,参与PD病理发展。
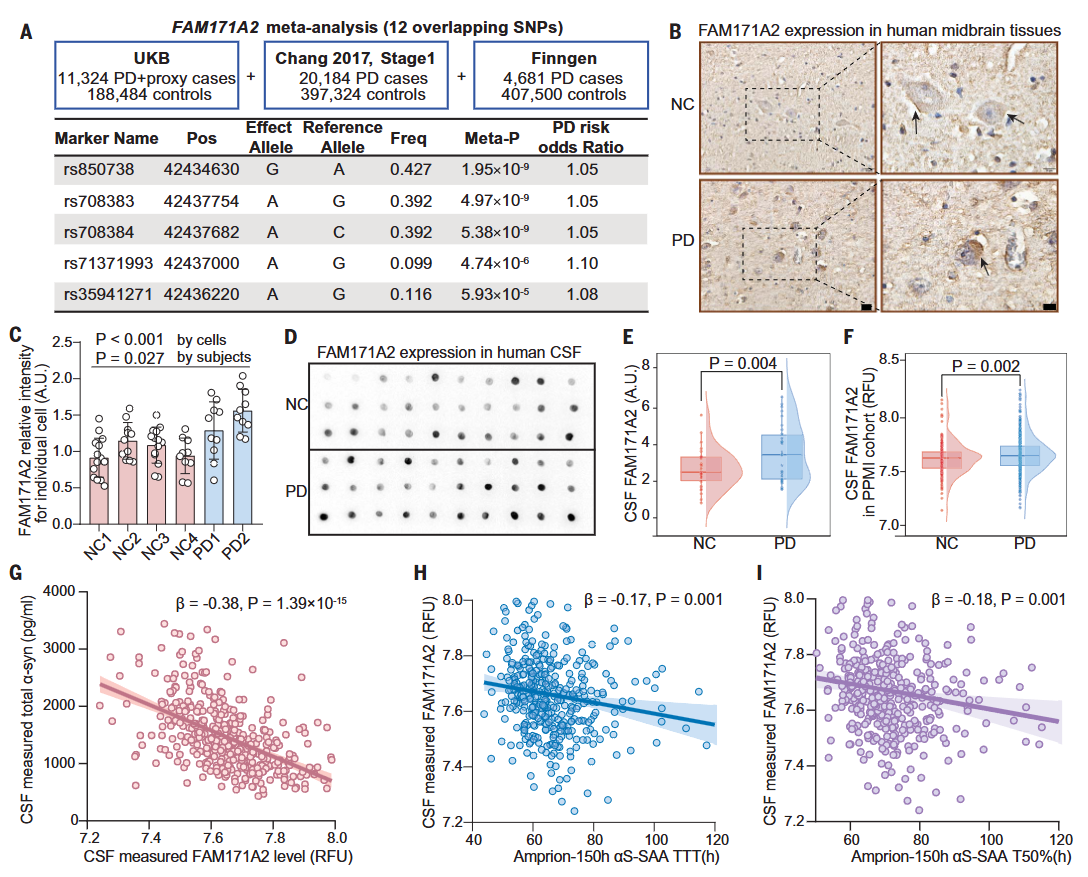
图1. FAM171A2是PD的风险基因
进一步地,通过在小鼠模型中过表达或敲低FAM171A2蛋白,结合体外细胞实验,研究团队揭示了FAM171A2介导神经元对PD病理蛋白α-syn淀粉样纤维的摄取和传播的致病机制,从而导致神经毒性并加重PD病理进展。特别地,通过体外研究发现FAM171A2通过胞外结构域1与α-syn淀粉样纤维的羧基末端区域通过静电力相互作用直接结合,且FAM171A2与α-syn淀粉样纤维具有与α-syn单体相比更高的结合亲和力。最后,研究人员基于已有的相互作用结构模型,通过人工智能的蛋白结构预测和高通量虚拟筛选技术,得到抑制FAM171A2与α-syn淀粉样纤维结合的小分子抑制剂bemcentinib,该小分子抑制剂在体外细胞模型中可有效抑制多巴胺能神经元对α-syn淀粉样纤维的摄取。
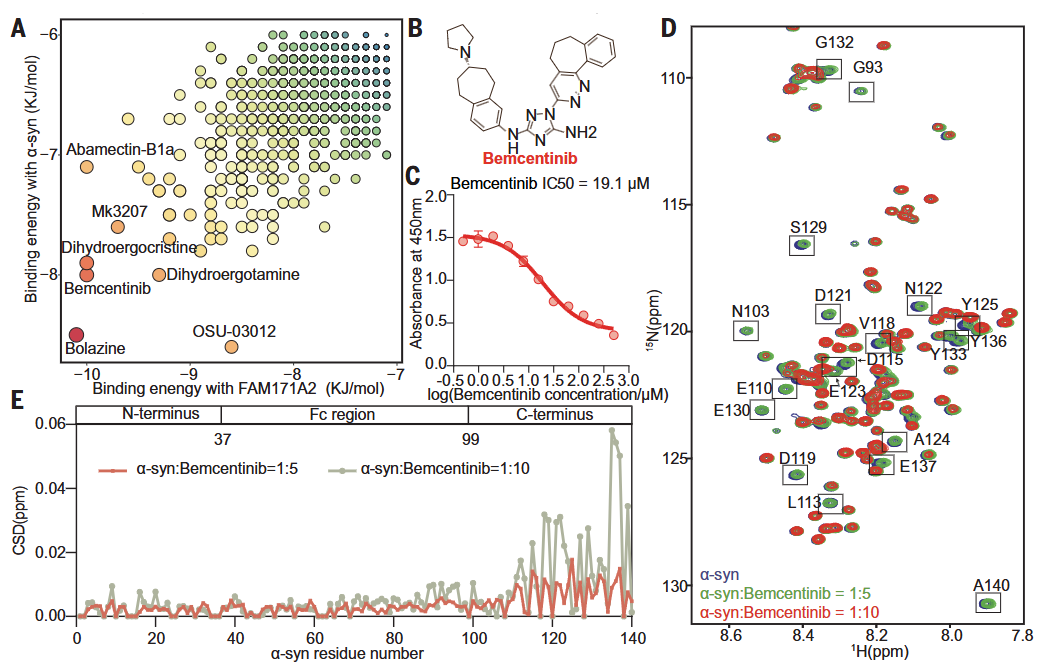
图2. 小分子bemcentinib抑制FAM171A2与α-syn淀粉样纤维的结合
综上,这一发现不仅提供了PD发病机制的新见解,也为开发针对这一致病机制的治疗策略提供了可能。虽然bemcentinib还需进一步优化改造及研究,以实现其透脑性及在临床应用中的安全性和有效性,但这项研究无疑为PD的治疗干预带来新的潜在治疗靶点及新的药物研发思路。
中国科学院上海有机化学研究所生物与化学交叉研究中心刘聪研究员与复旦大学附属华山医院郁金泰教授、复旦大学脑科学转化研究院袁鹏教授本研究共同通讯作者。复旦大学附属华山医院博士后吴凯敏为本研究第一作者。该工作得到了国家自然科学基金委、科技部、中国科学院及上海市科委等项目及基金的资助。
原文链接:Doi.org/10.1126/science.adp3645

