2月26日, 国际学术期刊Neuron在线发表了中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)沈义栋研究组联合上海交通大学医学院附属新华医院鄢秀敏团队的最新研究成果 “Macrophage-derived CTSS drives the age-dependent disruption of the blood-CSF barrier” 。该研究发现,在衰老过程中,脑室脉络丛中的巨噬细胞分泌大量蛋白酶Cathepsin S (CTSS),降解了脉络丛上皮细胞间的连接蛋白Claudin1(CLDN1),从而破坏血-脑脊液屏障,引发大脑功能减退。这一发现不仅阐明了衰老破坏血-脑脊液屏障的分子机制,也为保护血-脑脊液屏障、延缓大脑衰老提供了潜在药物靶点。
大脑作为人体的“司令部”,享有一套高度精密的保护机制,其中脑脊液扮演着重要角色。脑脊液将大脑和脊髓包裹其中,为中枢神经系统提供支持和保护,也是中枢神经微环境的重要组成部分。而脑室中的脉络丛则是脑脊液的“生产工厂”,它通过一层特殊的上皮细胞——脉络丛上皮细胞(CPEC)——将血液过滤并转化为脑脊液。这层CPEC不仅是一道“滤膜”,还构建了一道坚固的防御屏障:血-脑脊液屏障。通过紧密的细胞连接,CPEC有效隔绝了血液中的有害物质和炎症因子,保护大脑免受外界侵害。
然而,随着年龄的增长,这道屏障的“防御工事”逐渐脆弱,出现“漏洞”。血-脑脊液屏障的破损被认为与神经退行性疾病的发生和发展密切相关。然而,目前科学界对于这道屏障如何丧失完整性,以及其背后的分子机制,仍知之甚少。这些问题的解答,将为延缓大脑衰老、防治神经退行性疾病提供关键线索。
研究团队首先对不同年龄小鼠脉络丛上皮细胞间的紧密连接蛋白进行定量分析,发现随着衰老,仅CLDN1的水平显著下降。更重要的是,CLDN1的减少与血液成分渗入大脑及炎症反应增强呈正相关,提示CLDN1的缺失可能是血-脑脊液屏障破坏的关键因素。然而,无论是RNA水平还是总蛋白水平,CLDN1在年轻和年老小鼠脉络丛中的表达并无显著变化,这表明CLDN1减少并非源自基因表达的下调,而可能是受到某种细胞外因子的直接降解。
进一步研究发现,蛋白酶CTSS在老年小鼠脉络丛巨噬细胞中的表达显著升高,并大量富集于脉络丛腔内。值得注意的是,CTSS传统上被认为是胞内溶酶体中的蛋白酶,而本研究则发现CTSS可被大量分泌至胞外,直接作用于CPEC胞间连接处的CLDN1,导致其水平下降。通过给老龄小鼠喂食或脑室注射CTSS抑制剂,研究团队观察到CPEC间的CLDN1的水平得以恢复至年轻小鼠的水平,大脑炎症显著减轻,同时学习记忆能力提高,抑郁行为减弱。此外,通过腺相关病毒在老龄小鼠的CPEC中过表达抗CTSS降解的CLDN1,也取得了类似效果,表现为血-脑脊液屏障和神经功能的改善。而在年轻小鼠CPEC中敲除CLDN1则加剧了屏障受损,进一步证实了CTSS-CLDN1这对酶与底物在屏障衰老中的核心作用。
单细胞数据分析还揭示,脉络丛中衰老细胞的积累可能通过激活巨噬细胞释放CTSS,推动屏障破坏。通过检测CCR2敲除小鼠(巨噬细胞招募受限)脉络丛,以及清除老年小鼠脉络丛中的衰老细胞或在年轻小鼠中诱导衰老细胞,研究团队最终确认,衰老细胞是破坏血-脑脊液屏障的“幕后黑手”之一。
分子细胞卓越中心博士生陈一凡、助理研究员周一飞(现为哈佛医学院/麻省总医院博士后)以及博士生白雅卿为该论文的共同第一作者。分子细胞卓越中心沈义栋研究员、上海交通大学医学院附属新华医院鄢秀敏研究员和分子细胞卓越中心助理研究员周一飞为该论文共同通讯作者。分子细胞卓越中心石建涛研究员、陈正军研究员、贾凯雯副研究员和工作人员宋梦娇、戴钰敏以及新华医院青年研究员陈青霞参与研究工作。该研究得到了分子细胞卓越中心邹卫国研究员、朱学良研究员和王红艳研究员的大力支持和帮助。该研究还得到分子细胞卓越中心分子生物学技术平台、细胞分析技术平、生物信息学平台和动物实验技术平台的帮助与支持,和国家自然科学基金的资助。
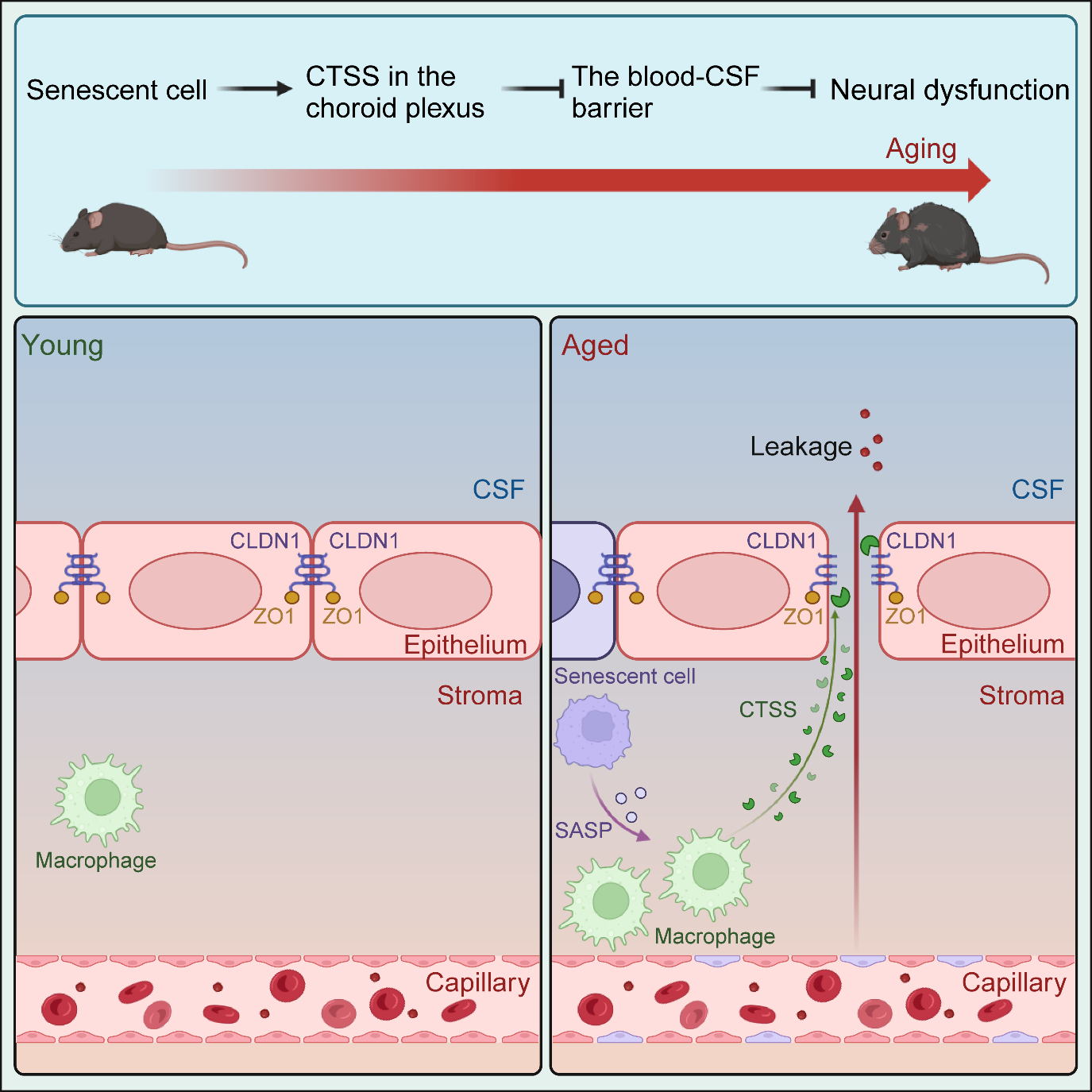
衰老过程中脉络丛中巨噬细胞分泌的CTSS破坏血-脑脊液屏障影响大脑功能的示意图
文章链接:https://doi.org/10.1016/j.neuron.2025.01.023

