3月5日,《Neuroscience Bulletin》在线发表了题为《新型小鼠模型揭示CDKL5截短突变引发的蛋白缺失机制》的研究论文。该研究由中国科学院脑科学与智能技术卓越创新中心熊志奇研究组完成,团队构建并表征了一种携带Cdkl5 C端截短突变的小鼠模型,揭示了无义介导的RNA降解(NMD)在CDKL5蛋白缺失中的关键作用。这一发现不仅深化了对希舞症(CDKL5缺乏症,CDD)的发病机制理解,还为基于遗传修复或药物干预的精准治疗提供了理论依据。
希舞症(CDD)是一种严重的X连锁神经发育障碍疾病,患者通常在出生后数月即出现癫痫症状,并伴随认知障碍、语言缺失、运动功能受损及自闭症谱系障碍等症状。临床研究发现,CDKL5基因的截短突变在CDD患者中十分常见,但不同突变对CDKL5蛋白的表达及功能影响并不明确。特别是,由于CDKL5基因编码的蛋白具有多个功能结构域,研究者们一直在探讨截短蛋白是否仍具部分功能,以及其功能缺失的主要分子机制。
为解决这一问题,研究团队聚焦于C端截短突变,构建了Cdkl5 492stop/Y小鼠模型,该模型携带一个常见的提前终止密码子(PTC),模拟人类CDKL5 C端的截短突变。研究发现,该小鼠不仅在分子层面表现出CDKL5蛋白的完全缺失,还在行为和神经生理上展现了典型的CDD样表型,包括神经发育受损、树突棘密度改变、运动功能缺陷以及自发性癫痫样活动。更重要的是,研究发现这类突变通过激活NMD通路,导致突变mRNA被降解,从而完全阻止CDKL5蛋白的翻译。
研究团队进一步展开研究发现,提前终止密码子的位置对NMD机制的影响至关重要。当PTC出现在氨基酸763位点(含)之前时,NMD机制通常会触发mRNA降解,导致CDKL5蛋白完全缺失。而当PTC逃逸NMD时,mRNA表达正常,仍可翻译出截短蛋白。这一发现为不同CDD患者的临床差异提供了分子层面的解释,并强调了突变位置的重要影响。
这一发现不仅深化了CDD的分子疾病机制,还为其他涉及NMD机制的神经发育疾病研究提供了重要参考。未来,结合患者细胞及临床数据的进一步研究,将有望筛选出更具临床价值的治疗策略,为希舞症及其他X连锁神经发育障碍患者带来新的治疗希望。
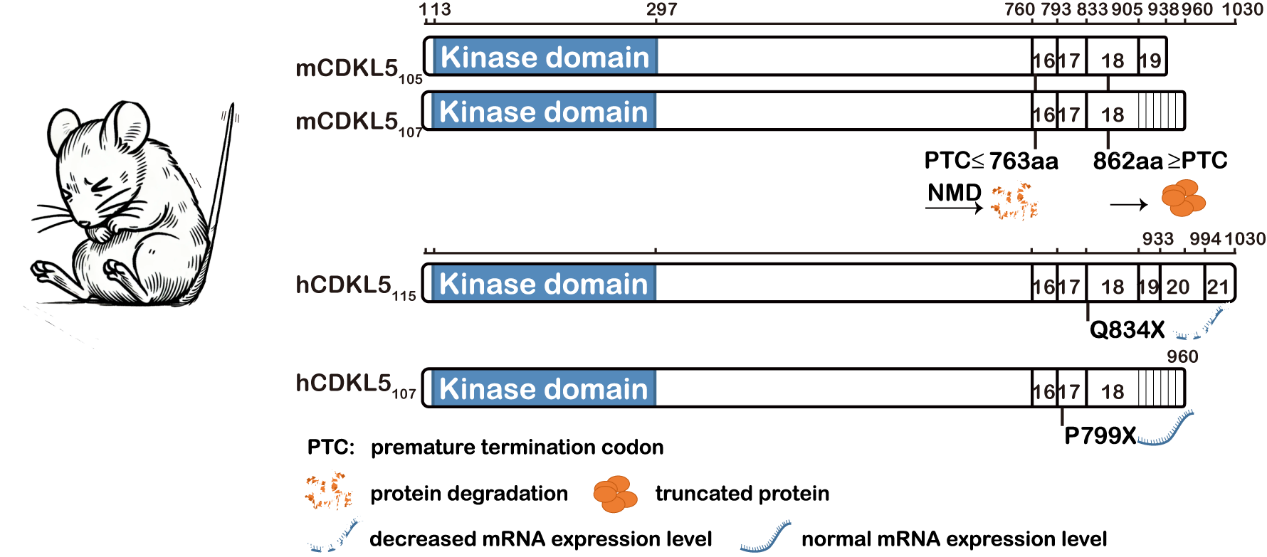
截短突变影响CDKL5蛋白表达的示意图
本研究由熊志奇研究员指导,封雪博士为第一作者,朱姊艾博士、王红涛博士、周慧文、刘霁纬博士、沈亚、张玉仙等人亦做出重要贡献。本研究受到国家科技创新2030重大项目、科技部、国家自然科学基金委和上海市科委的经费资助。

