4月3日,国际学术期刊PNAS在线发表了中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)周斌研究组与香港中文大学吕爱兰研究组的合作研究成果,题为“Dual genetic tracing demonstrates the heterogeneous differentiation and function of neuromesodermal progenitors in vivo”。该研究构建了双同源重组酶系统,成功建立了体内神经中胚层祖细胞(Neuromesodermal progenitors,NMPs)的谱系示踪及功能研究技术,并结合单细胞转录组测序技术,深入揭示了NMPs在胚胎发育中的细胞命运和分子特征。这一研究不仅揭示了NMPs在胚胎发育中的分布、分化潜能和功能,更为脊髓损伤的细胞治疗提供了新的研究方向。
脊髓作为中枢神经系统的重要组成部分,承担着神经信号传导和肌肉运动协调等关键功能。然而,目前针对脊索退行性病变及外源性脊髓损伤的治疗手段仍存在明显局限。体外细胞实验表明,NMPs不仅能够分化为脊髓中的神经细胞,还可以产生周围的中胚层组织,在脊髓损伤的细胞治疗中具有重要应用前景。尽管既往研究已经证实NMPs具有双向分化潜能,但缺乏在体内直接示踪和功能评估的遗传工具。因此,开发精准靶向体内NMPs的技术对于揭示其细胞命运和功能至关重要。
在该项研究中,研究团队设计和构建了多种双同源重组酶系统,成功建立了哺乳动物体内特异性标记NMPs的遗传谱系示踪新技术。研究发现,NMPs具有双向分化潜能,能够同时生成神经细胞和中胚层细胞。此外,通过特异性清除NMPs的实验,研究人员发现NMPs减少导致胚胎躯干和尾部发育异常,进一步证实了NMPs在胚胎发育中的关键作用。相关研究成果不仅解答了重要的发育生物学问题而且为脊髓损伤的临床治疗提供了重要的理论基础和研究思路。
研究团队首先对小鼠胚胎期8.5天的尾端组织进行单细胞测序。通过分析,将细胞主要分为14个不同的簇,包括NMPs、Neural tube、Somite和Presomitic mesoderm等。进一步深入分析,研究人员发现NMPs特异性表达Brachyury(T)和Sox2,同时高表达Nkx1-2、Epha5、Fgf17和Fgf8等分子标志基因。研究还揭示了NMPs的分化受到Wnt、FGF和BMP等信号通路的精密调控:Wnt和FGF信号通路促进NMPs向中胚层分化,而BMP信号通路则通过抑制Sox2的表达推动NMPs向中胚层命运转变;相反,视黄酸(RA)信号通路通过抑制Wnt信号促进NMPs向神经命运分化。
为精准示踪NMPs,研究人员利用Dre-rox和Cre-loxP两套同源重组系统,分别构建了T-DreER和Sox2-CreER基因敲入遗传工具小鼠,来分别标记T来源和Sox2来源的细胞。研究团队设计了两套遗传策略来特异性标记示踪体内NMPs。在第一套策略中,研究人员使用Rosa26-traffic light reporter(Rosa26-CAG-rox-Stop-rox-ZsGreen-insulator-CAG-loxP-Stop-loxP-tdTomato,R26-TLR)系统。通过Tamoxifen诱导,可以在T-DreER;Sox2-CreER;R26-TLR小鼠体内同时分别标记T+细胞(ZsG+,绿色荧光)、Sox2+细胞(tdT+,红色荧光)以及T+Sox2+双阳性细胞(ZsG+tdT+,呈现黄色荧光)。这一方法成功实现了在单个胚胎中同时追踪T+、Sox2+和T+Sox2+三群细胞。为了更加清晰直观的标记NMPs,探究NMPs的细胞定位、细胞运动和分化的细胞类型,研究人员开发设计了第二套策略,R26-RL-GFP(Rosa26 rox-Stop-rox-loxP-Stop-loxP-eGFP)系统。在T-DreER;Sox2-CreER;R26-RL-GFP三基因小鼠中,只有Dre-rox和Cre-loxP双重重组的情况下才会激活GFP表达,从而特异性地标记T+Sox2+的NMPs。通过这两套双重组酶介导的遗传标记系统,研究人员成功追踪了NMPs在胚胎发育过程中的时空分布,发现这些细胞主要定位于胚胎的尾部区域,参与神经管、轴旁中胚层以及部分内胚层组织的形成。
为了探究单个NMP是否具有双向分化潜能,研究团队利用R26-confetti2报告系统进行单细胞克隆分析。通过低剂量Tamoxifen诱导,研究人员在E8.5成功标记了单个NMP。进一步结果显示,单个NMP能够分化为神经细胞克隆、中胚层细胞克隆或同时生成两种细胞类型的混合克隆。这一发现直接证实了NMPs在体内的双向分化潜能。此外,研究人员还发现少数NMPs还能够分化为内胚层细胞。这一发现扩展了NMPs在胚胎发育中的已知贡献,揭示了其在多胚层组织形成中的潜在作用。
接下来为了进一步阐明NMPs在胚胎发育中的功能,研究团队开发了T-DreER;Sox2-CreER;R26-LR-DTR小鼠模型,通过双重组酶介导白喉毒素受体(DTR)的表达,从而特异性清除NMPs。实验结果显示,NMPs的清除会导致胚胎躯干和尾部发育严重异常,表现为尾部缩短和躯干结构畸形。这一结果直接证明了NMPs在胚胎发育中的关键作用。研究还发现,NMPs的清除时间点对其功能影响显著。E8.5清除NMPs仅导致轻微的尾部发育缺陷,而E10.5清除则会引发严重的躯干和尾部发育异常,这一现象可能与胚胎发育过程中其他细胞群体的代偿作用有关。
综上,这项研究通过开发新型遗传工具,首次在体内实现了对NMPs的特异性遗传标记、示踪和功能评估。研究不仅深化了对NMPs在胚胎发育中作用机制的理解,为疾病建模、药物研发以及细胞治疗等领域的发展奠定了重要基础,更为再生医学领域提供了新的研究方向,具有重要的科学意义和潜在临床应用价值。
分子细胞卓越中心周斌研究组副研究员金恒薇和博士生刘子鑫为该论文共同第一作者。分子细胞卓越中心周斌研究员和香港中文大学吕爱兰教授为该论文共同通讯作者。该研究得到南模生物、国家蛋白质科学中心(上海),以及分子细胞卓越中心动物实验技术平台、细胞分析技术平台和分子生物学技术平台的大力支持和帮助。该工作得到中国科学院、基金委、科技部、上海市科委、香港研资局、新基石科学基金会等支持。
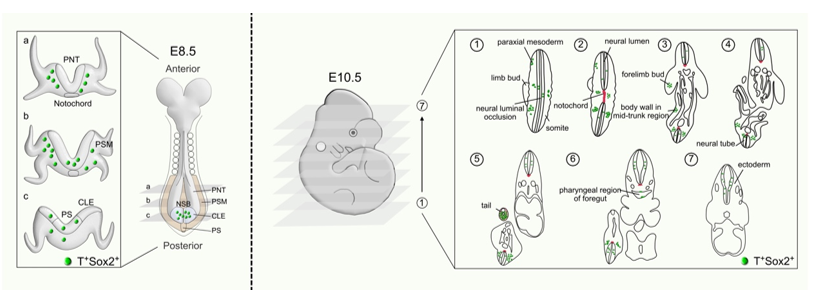
示踪的NMPs在胚胎E8.5和E10.5的时空分布

