6月26日,国际学术期刊PNAS在线发表了中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)李振斐研究组联合中国科学院上海药物研究所/国科大杭州高等研究院胡有洪研究组,复旦大学代谢与整合生物学研究院任若冰研究组和中国科学院上海药物研究所/国科大杭州高等研究院刘佳研究组的合作研究成果,题为:“Fine structural design of 3βHSD1 inhibitors for prostate cancer therapy”。该研究基于AlphaFold2预测3βHSD1三维结构并开展精细药物设计,开发了3βHSD1新抑制剂HEAL-116,兼具优越的3βHSD1抑制效力和良好的药代动力学特性,为前列腺癌治疗、克服二代抗雄药物(Androgen Receptor Pathway Inhibitors,ARPIs)耐药性提供了新策略。
前列腺癌(Prostate Cancer,PCa)是全球男性最常见的恶性肿瘤之一。靶向雄激素-雄激素受体(Androgen Receptor,AR)信号通路的激素治疗有效地延缓了前列腺癌进展。然而药物耐受不可避免,晚期前列腺癌的后续治疗需要新的治疗靶点和治疗策略。
李振斐研究组前期发现代谢酶3βHSD1介导的雄激素代谢、甾体代谢和药物代谢推动了前列腺癌的恶性进展,在阿比特龙(Abiraterone)、恩杂鲁胺(Enzalutamide)等二代抗雄药物的耐药中起关键作用,并率先鉴定到3βHSD1的抑制剂biochanin A(BCA)。然而BCA口服生物利用度低,导致其难以临床转化。该研究工作通过多维度计算生物学手段突破结构解析瓶颈,实现了3βHSD1抑制剂的精准高效优化。
研究人员通过整合AlphaFold2蛋白质结构预测、分子动力学模拟及量子化学计算等技术,成功构建了3βHSD1的高精度三维结构模型,并揭示其独特的催化机制和底物结合口袋特征。在此基础上,研究团队对3βHSD1抑制剂BCA进行系统性结构优化,通过精准的分子空间构型和电荷分布,设计出一系列新型高效抑制剂,最终筛选出HEAL-116作为高效特异性抑制剂。HEAL-116不仅增强了与3βHSD1底物结合口袋的特异性,还通过引入亲水基团显著提高了其口服生物利用度。研究人员对HEAL-116进行了一系列体外和体内的生物学功能验证。体外实验显示HEAL-116能有效抑制3βHSD1活性,且不引发转录组显著改变和激酶组活性变化。体内实验进一步证实,HEAL-116单药治疗可抑制前列腺癌移植瘤生长;与二代抗雄药物联用时更呈现协同增效作用。该研究工作证实基于人工智能预测结构的理性药物设计策略,为克服前列腺癌耐药性提供了全新的策略,更为3βHSD1靶向治疗的临床应用奠定了重要基础。
分子细胞卓越中心博士研究生何东印、张宇航,中国科学院大学杭州高等研究院硕士研究生张璐瑶、陈菁菁,复旦大学代谢与整合生物学研究院博士后玉蕾叶为该文的共同第一作者。复旦大学唐惠儒研究组和中国科学院营养与健康研究所李昕研究组也为相关工作的开展提供了重要支持。本工作得到了分子细胞卓越中心动物平台、分子平台、细胞平台和上海营养与健康研究所生物医学大数据中心等平台机构的支持。该工作得到了科技部“前沿生物技术”重点专项,基金委医学部重点项目和原创药物专项项目等基金的支持。
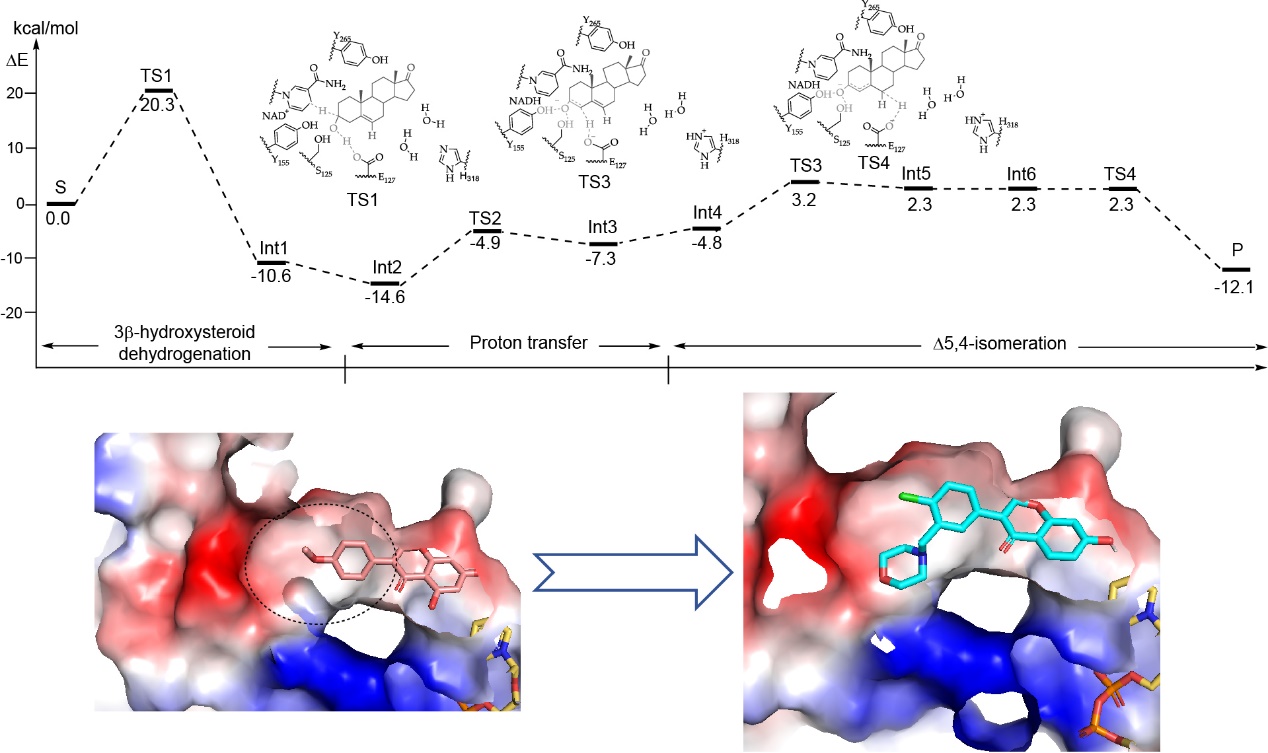
基于3βHSD1酶活机理和空间构象的药物设计和开发
文章链接:https://doi.org/10.1073/pnas.2422267122

