细胞周期蛋白依赖性激酶12(CDK12)及其旁系同源蛋白CDK13通过磷酸化RNA聚合酶II调控转录延伸和持续合成能力,是多种癌症的潜在治疗新靶标。在晚期前列腺癌和卵巢癌中,CDK12失活突变定义了独特的疾病分子亚型。研究表明,CDK12失活与晚期前列腺癌肿瘤内T细胞水平升高相关。我们前期工作发现,小鼠前列腺上皮细胞中Cdk12基因缺失会诱发伴有淋巴细胞浸润的癌前病变,且CDK12与CDK13存在旁系同源合成致死关系。然而,这些表型背后的机制及其治疗意义尚未明确。近期,中国科学院上海有机化学研究所生命过程小分子调控全国重点实验室丁克课题组和密西根大学Arul M. Chinnaiyan团队合作,揭示了CDK12/13失活在临床前模型中激活STING介导的抗肿瘤免疫的分子机制(J. Clin. Invest.2025. DOI: 10.1172/JCI193745)。
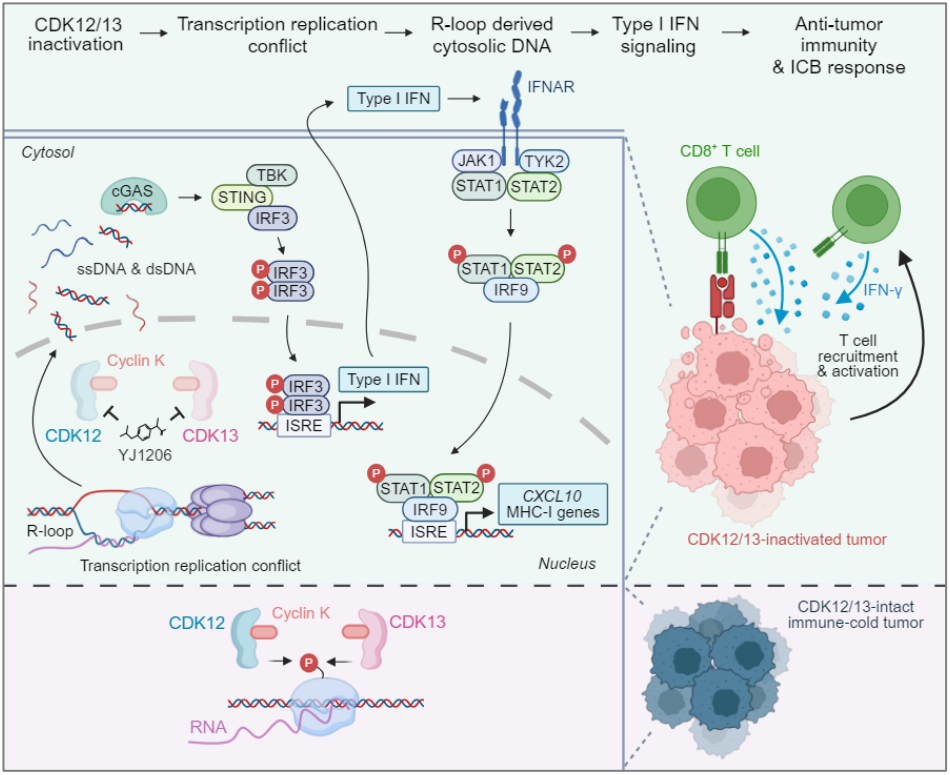
本研究发现,CDK12/CDK13的基因或药物失活,能强力激活多种癌症类型中的干扰素基因刺激因子(STING)信号通路。临床队列分析显示,CDK12/13表达降低与患者生存改善及免疫检查点阻断(ICB)治疗反应增强相关。机制研究表明,CDK12/13缺失或靶向降解可诱导胞质核酸释放,从而触发STING通路激活。在同源肿瘤模型中,CDK12/13降解不仅能延缓肿瘤生长,还与抗PD-1疗法产生协同效应——通过增强STING活性和促进CD8+ T细胞在肿瘤内的浸润与活化。值得注意的是,这种联合疗法的抗肿瘤效应依赖于STING信号传导及功能性CD8+ T细胞。这些发现确立了STING激活作为CDK12突变癌症中T细胞浸润和"免疫热"肿瘤微环境形成的关键驱动因素,提示CDK12/13双重抑制剂和降解剂可通过激活抗肿瘤免疫来增强免疫疗法的治疗效果。
此前,丁克课题组和 Arul M. Chinnaiyan团队通过合作,已在口服可吸收的高选择性CDK12/13降解剂的设计合成等方面取得系列进展(J. Med. Chem.2022,65,11066;J. Med. Chem. 2024,67,18247;Cell Rep. Med.2024,5,101752)。另外,合作团队通过靶向CDK12/13 ATP口袋前沿柔性区域的半胱氨酸获得了高选择性的CDK12/13共价抑制剂(J. Med. Chem. 2025,68,6718)。利用这些分子为工具,合作团队进一步探索了靶向CDK12/13在治疗前列腺癌(Cell Rep. Med.2024,5,101758)和卵巢癌(PNAS2025,122,e2426909122)等疾病的可行性。

