2025年8月20日,《Nature Communications》在线发表了题为“Designed optogenetic tool for bridging single-neuronal multimodal information in intact animals”的重要研究成果,该研究由中国科学院脑科学与智能技术卓越创新中心(神经科学研究所)杜久林研究组完成。该研究成功开发了名为Pisces(Photo-inducible single-cell labeling system)的光遗传学工具,以斑马鱼为模型,首次在活体脊椎动物中实现了任意单个神经元的形态、活动与分子信息的整合标记(图1)。这一突破性技术填补了神经科学领域长期存在的技术瓶颈,为构建全脑尺度单神经元多模态图谱提供了重要手段。
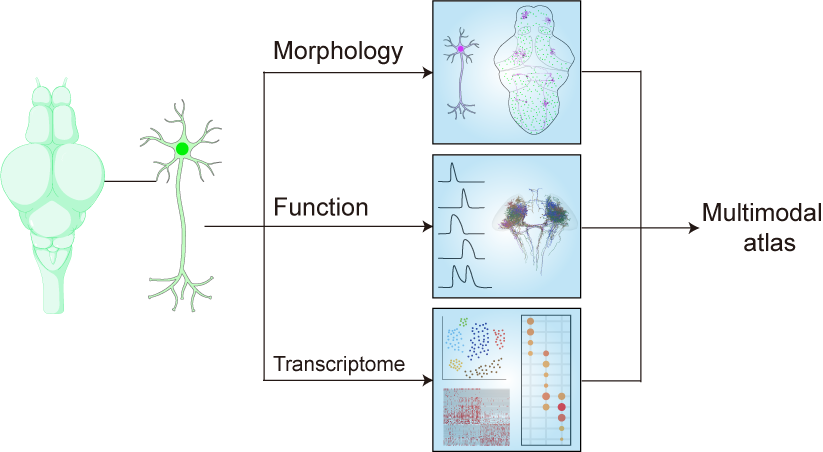
图1. 利用Pisces系统实现对活体大脑中单个神经元的分子、形态和活动数据的整合。
大脑神经网络由数量庞大且类型多样的神经元组成,全面理解其功能必须同步获取单细胞层面的形态结构、活动状态与分子特征。然而,传统随机稀疏标记方法需要耗时数周,且难以精确锁定目标神经元;现有光遗传学手段则受限于信号泄漏、效率低和扩散速度慢等问题,无法快速呈现长程轴突投射,并且与功能成像、分子分析的兼容性不足。
Pisces的核心创新在于设计了一种核定位光控蛋白转运系统。研究团队将光裂解蛋白(PhoCl)与光转换荧光蛋白(mMaple)融合,并通过精确平衡核定位信号(NLS)与核输出信号(NES),使荧光蛋白在激发前严格定位于细胞核内。405 nm激光照射可瞬时切割PhoCl,使mMaple从绿色转为红色,并在NES的主动运输作用下以约1.02 μm/s的速度快速扩散至整个细胞,从而在小时级时间内标记完整神经元形态,显著快于传统方法的被动扩散(10-50倍)。在斑马鱼模型中,Pisces可在暗场或环境光下精准标记任意单个神经元,实现相邻细胞的高分辨率区分,同时支持一次性追踪多个跨脑区神经元,成功绘制包括蓝斑核去甲肾上腺素能神经元在内的复杂全脑投射图谱。
更为重要的是,Pisces与多种神经科学研究技术高度兼容。在功能成像方面,研究团队将Pisces与在体钙成像结合,首次在斑马鱼视顶盖区建立了神经元“活动类型—完整形态类型”的配对数据,揭示了投射型与中间型神经元在光响应特性和树突分布上的显著差异,并发现控制捕食的对侧投射神经元具有更复杂的树突结构与多样的光响应模式。在分子分析方面,团队利用流式分选提取已激活的Pisces神经元,开展单细胞RNA测序,解析了缰核左右侧神经元在信号通路上的差异(如右侧富含谷氨酸信号、左侧与肽类合成相关),并结合荧光原位杂交(FISH)验证了单神经元形态与基因表达的空间对应关系,揭示了包括缰核与中脑在内的不同脑区细胞类型和功能特性。
该新技术突破了“全脑尺度单神经元多模态解析”的技术壁垒,为理解神经环路提供了“结构—活动—分子”三位一体的新研究视角(图2)。研究团队计划将该技术进一步拓展至包括哺乳动物在内的其他模式动物,使之广泛应用于神经科学研究领域。

图2. Pisces通过整合活体斑马鱼大脑单神经元形态、活动与基因多模态信息,解析单神经元多模态信息。
中国科学院脑智卓越中心杜久林研究员和副研究员陶荣坤(现厦门大学医学院副教授)为该论文的共同通讯作者,陶荣坤博士和孙乐博士为该论文的共同第一作者,钱昱、陈钰涵、黄奕铭、孙怡迪研究员以及温州医科大学附属台州医院的关春雨医生、王明仓主任对该研究做出了重要贡献。该研究获得了国家科技创新2030重大专项、科技部重点研发计划、国家自然科学基金、上海市自然科学基金及中国科学院青促会等基金的资助。

