细胞自噬是哺乳动物细胞内一种高度受调控的,利用溶酶体来降解蛋白聚集体、受损细胞器、入侵病原体等无用或有害成分以应对细胞生存压力和维持细胞自身动态平衡的重要代谢过程。细胞自噬在细胞生长、天然免疫、衰老等众多的生理过程中扮演着重要的角色。同时,细胞自噬的功能异常与癌症、神经退行性疾病等诸多的人类疾病密切相关。在经典的氨基酸饥饿引发的巨自噬过程中,细胞通过自噬前体结构(PAS)的引发、延伸进而形成自噬体来包裹细胞内待降解的自噬底物。在PAS的引发和延伸阶段,WIPI2和FIP200均通过与ATG16L1的相互作用,将ATG12~ATG5-ATG16L1复合物(ATG16L1复合物)招募至PAS上,进而使其实现对ATG8家族蛋白的脂质化修饰。中国科学院上海有机化学研究所生命过程小分子调控全国重点实验室的潘李锋研究组长期致力于细胞自噬的分子机制研究,课题组前期的研究工作已详细阐明WIPI2招募并激活ATG16L1复合物的分子机制(Science Advances. 2023, 9(9):eadf0824;Autophagy. 2023, 20(4):938-940.)。但是,过去对于FIP200在ATG16L1复合物被招募至PAS过程中的具体分子机制仍不清楚。
近期,潘李锋研究组详细研究了FIP200与ATG16L1之间的相互作用机制,并在《Nature Communications》杂志发表了题为“Molecular bases of the interactions of ATG16L1 with FIP200 and ATG8 family proteins”的研究论文(https://www.nature.com/articles/s41467-025-64097-4)。在该项研究中,该团队首先综合运用荧光极化实验、等温滴定量热技术、多角度静态光散射和液体核磁共振等多种表征手段,发现ATG16L1包含一段FIP200结合区域(FIR),这段区域不仅能直接结合FIP200的Claw结构域,还可以作为非经典的ATG8相互作用基序(AIM)选择性地识别哺乳动物ATG8家族蛋白(ATG8s)。随后,通过解析ATG16L1 FIR分别结合FIP200的Claw结构域和ATG8家族蛋白GABARAPL1的两个复合物晶体结构,该团队详细阐明了ATG16L1结合FIP200和ATG8s的分子机制。同时,该团队的相关生化实验结果表明,ATG8s会与FIP200竞争结合ATG16L1,而WIPI2和FIP200会同时结合ATG16L1。为了区分FIP200/ATG16L1和ATG8s/ATG16L1相互作用在相关自噬过程中各自的贡献,该团队通过理性设计获得了特异性只结合ATG8s的ATG16L1 DRIF突变体,以及ATG8s和FIP200均不结合的ATG16L1 IQIQ突变体。随后,该团队利用上述突变体并通过相关的细胞生物学实验发现,FIP200/ATG16L1相互作用对于氨基酸饥饿引发的经典巨自噬的正常进行是不可或缺的,而ATG8s/ATG16L1相互作用起到抑制自噬的作用。最后,基于相关的研究发现,该团队首次提出FIP200/ATG16L1和WIPI2/ATG16L1相互作用在氨基酸饥饿引发的经典自噬过程中通过正反馈作用增强自噬起始过程的作用模型。
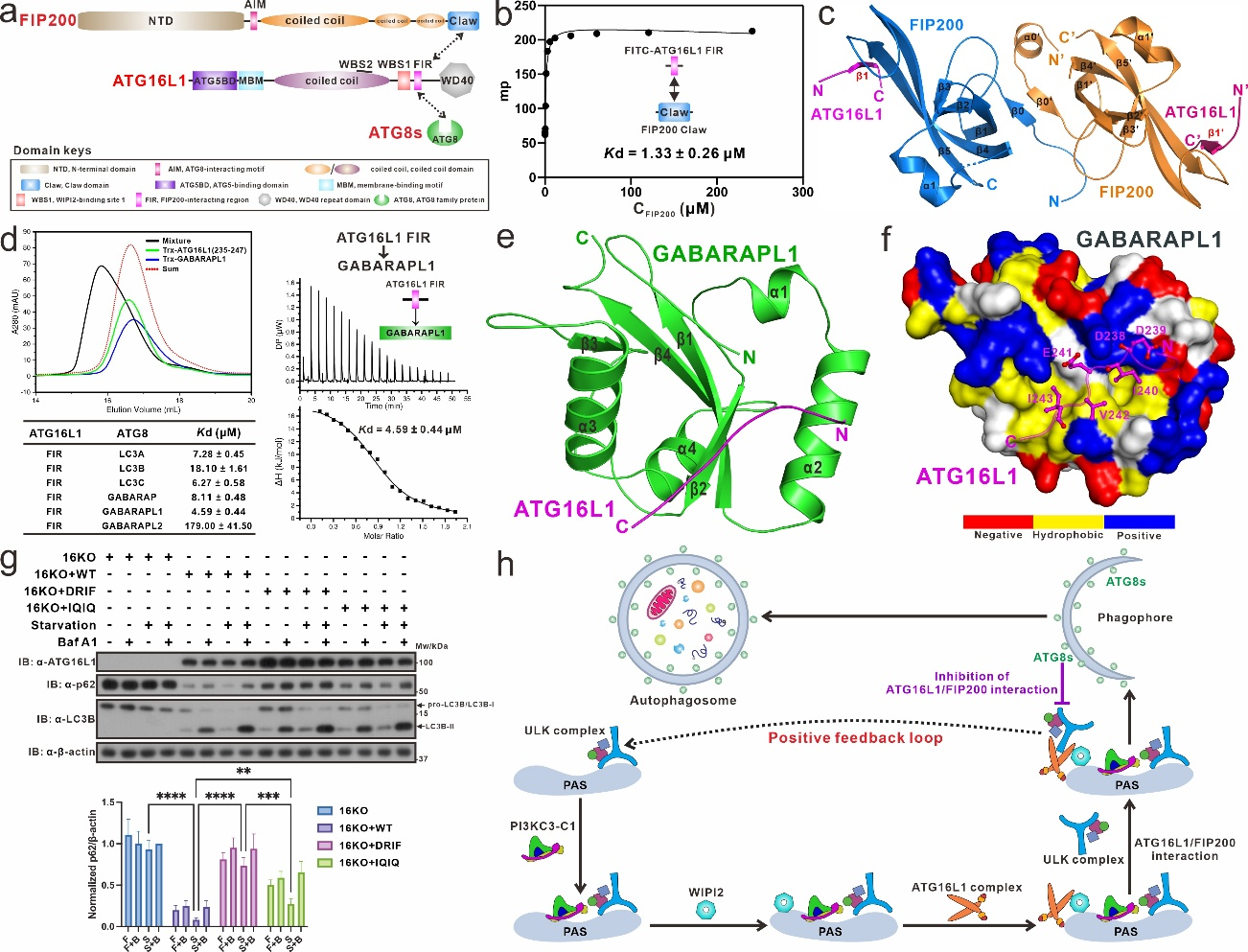
图1. ATG16L1结合FIP200和ATG8家族蛋白的分子机制
综上所述,本项研究工作对核心自噬蛋白ATG16L1、FIP200和ATG8家族蛋白之间的相互作用机制进行了详尽的生化和结构表征,首次发现发现ATG16L1可通过其FIR区域竞争结合FIP200和ATG8家族蛋白,并通过解析相关的复合物晶体结构详细揭示了ATG16L1结合FIP200和ATG8家族蛋白的分子机制,同时通过细胞功能实验证实了FIP200/ATG16L1在经典自噬过程中发挥着不可或缺的重要作用。相关的研究发现为进一步揭示经典自噬过程的分子机制奠定了基础。
潘李锋课题组已毕业的龚新宇博士和未毕业的博士生周玉倩为本文的共同第一作者。上述研究工作得到国家自然科学基金委、科技部、上海市科委、中国科学院和生命过程小分子调控全国重点实验室的资助。

