2025年11月12日,NEURON期刊在线发表题为“Globally patterned locus coeruleus-norepinephrine neuron-pericyte coupling orchestrates brain-wide vascular dynamics”的研究论文。该工作由中国科学院脑科学与智能技术卓越创新中心(神经科学研究所)杜久林研究团队完成。研究揭示,作为调节大脑觉醒状态的重要神经枢纽,蓝斑去甲肾上腺素能(locus coeruleus-norepinephrine,LC-NE)神经元在全局脑血流调节中扮演“司令部”角色,通过驱动具有特定时空模式的周细胞活动,统筹协调全脑范围的血流分配。
稳定而充足的血流供应对维持大脑正常功能与内环境稳态至关重要。在局部层面,神经元活动可引起局部血管舒张与血流增加,此过程被称为神经血管耦合(neurovascular coupling,NVC)。 经过二十多年的深入研究,科学家对NVC在局部脑血流调节中的作用与机制已有较为系统的认识。随着大规模神经元活动记录技术的发展,研究发现即使是简单的感觉信息处理或行为也能引起全脑范围广泛的神经元激活。然而,受限于大范围、高时空分辨率成像技术,全脑尺度上血流调节机制仍不清楚。因此,本研究致力于探索大脑如何在全局水平上调节血流,以实现有限资源在不同脑区之间的合理调配。
斑马鱼幼鱼全脑透明且尺寸小,适于长时程、大范围的在体成像与细胞水平的观察,为全脑血流调节机制研究提供了理想模型。杜久林研究团队在前期工作中,建立了在在体斑马鱼上研究大脑血管网络发育及其神经调节的实验体系,揭示了脑血管网络的形成规律及其优化机制(PLoS Biology 2012,10:e1001375,doi: 10.1371/journal.pbio.1001374),发现了大脑血管网络形成过程中内皮细胞入脑路径选择的分子机制(Neuron 2020,108:180-192,doi: 10.1016/j.neuron.2020.07.025),阐明了包裹脑血管外壁的周细胞入脑的调控机制(Cell Reports 2024,43:113652,doi: 10.1016/j.celrep.2023.113652)。
本工作则在上述基础之上,研究团队通过对多种神经与血管细胞类型进行全脑在体成像,观察到覆盖于血管外壁的周细胞展现出全脑范围内、具有血管层级特异性的时空活动变化,且在时程上跟随LC-NE神经元的活动,即LC-NE神经元-周细胞耦合(LC-NE neuron-pericyte coupling,LPC)现象。结合光/化学遗传学、双光子损毁、药理学干预、全脑血流模拟及行为学等多种技术手段,研究团队进一步发现,LC-NE神经元通过其释放的去甲肾上腺素(NE)以及经由放射状胶质细胞中继的间接途径,协同作用于毛细血管周细胞(capillary pericytes,CPs)和毛细血管前小动脉周细胞(arteriole-end pericytes,AEPs),共同导致具有时空特征的全脑范围周细胞的激活。伴随局部NVC的发生,LPC引起相对延迟的全局血管收缩,这一方面加速了全脑血管网络重置,另一方面通过促进脑区间血流调配增强局部NVC的血流变化,从而更高效地满足代谢需求。
该研究系统解析了由LC-NE能神经元-胶质细胞-周细胞-血管协同的全局脑血流调配机制,揭示了协调全脑血流动态的生理意义,并提示大脑可通过LC-NE系统,协调大脑血管网络和神经网络的功能状态。
中国科学院脑智卓越中心杜久林研究员和博士毕业生孙乐为该论文的共同通讯作者,孙乐博士和脑智卓越中心彭小兰博士为该论文的共同第一作者。脑智卓越中心訾化星、张朕坤、龚雨晨、李佳、朱宇齐、杨以清及上海交通大学曹核威在研究中作出相应贡献。上海交通大学胡丹教授、脑智卓越中心王凯研究员为该工作提供了重要指导。该研究得到国家基金委、上海市和中国科学院相关基金的资助。
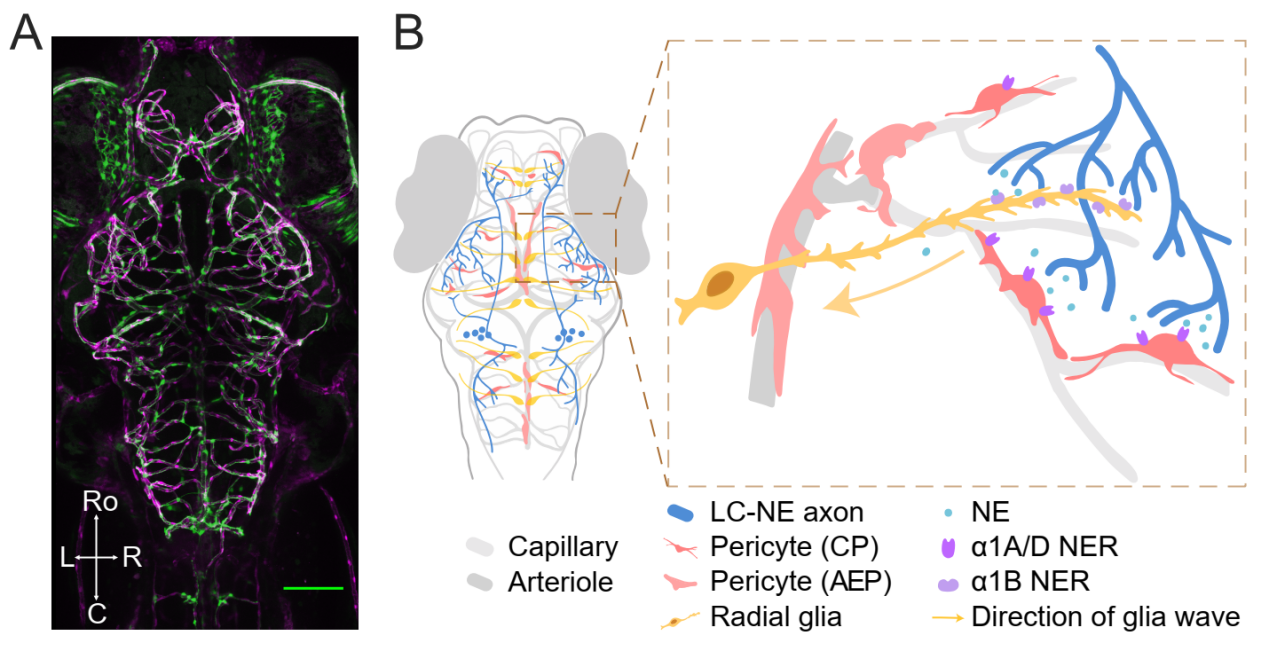
LC-NE神经元-周细胞耦合(LPC)的工作机制
图A:全脑血管网络(红色)和周细胞(绿色)分布
图B: LC-NE神经元通过直接释放NE与胶质细胞中继的间接作用,实现对全脑周细胞的调节
联系人:孙乐(lsun@ion.ac.cn)

