上海有机所烷烃碳氢键不对称官能化研究取得重大突破
文章来源: | 发布时间:2016-09-05 | 【打印】 【关闭】
中科院上海有机所的刘国生研究团队通过发展金属催化的自由基接力新策略,成功地实现了铜催化苄位碳氢键的不对称氰化反应,以最短的路线合成了手性腈类化合物。这一研究成果于9月2日发表在国际权威学术杂志《科学》上(Science, 2016, 353, 1014)。
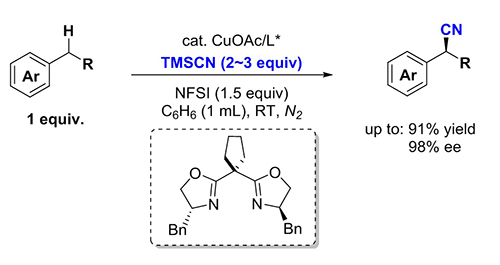
铜催化苄位碳氢键的不对称氰化反应
碳氢键活化是有机化学中的圣杯,通过烷/芳烃的碳氢键直接官能化是合成有机化合物最为直接高效的新方法;但是在反应活性和选择性等方面存在诸多的问题,尤其是在碳氢键不对称催化领域面临具大的挑战,因此需要发展新的概念、新策略来实现碳氢键的高效转化。目前该领域的研究主要是围绕过渡金属活化碳氢键的策略展开的,通过定位基团的辅助可以实现碳氢键的不对称官能化;但是该策略对于普通(无定位基团)芳/烷烃而言,碳氢键活化及其不对称催化一直没有得到解决。相对而言,受酶化学的启发而发展的自由基策略是普通烷烃碳氢键官能化的一种非常有效的途径;但是反应所涉及的碳自由基中间体具有很高的活性,导致反应的选择性控制非常困难,基于该策略来发展碳氢键不对称官能化鲜见报道。
中国科学院上海有机化学研究所刘国生研究员的研究团队近年来致力于自由基化学的选择性控制方面的研究,他们提出将反应中的碳自由基中间体转化为金属有机物种来实现选择性控制的策略,籍此来解决烷烃的C-H键直接不对称直接官能化的难点问题。通过发展金属催化/自由基接力的新策略,利用原位形成的高活性的自由基来攫取苄位的氢,在温和条件下生成的苄位自由基,再与手性噁唑啉/铜氰络合物迅速地、高立体选择性地结合形成高活性的有机金属铜中间体,通过金属中心高立体选择性的还原消除,实现了碳自由基的不对称控制,成功地发展了苄位碳氢键的不对称氰化反应,无需邻位定位基团的参与就可以实现从苄位碳氢键到手性芳基乙腈的直接高效的转化。
刘国生团队发展的方法具有广谱的官能团兼容性,出色的化学、区域和立体选择性,以最短的路线、高效地制备了各种光学纯腈类化合物。最后通过与美国威斯康辛大学麦迪逊分校的Stahl教授合作,阐述了碳自由基与手性铜氰络合物的对映体选择性的C-CN成键过程。
在上述的研究中,所发展的新策略充分结合了自由基化学的高活性和金属催化的高选择性,成功地解决了无辅助配位条件下烷烃碳氢键的不对称氰化反应。该研究不仅为不对称自由基反应的研究提供了新的反应模式,而且为后期进一步研究烷烃的不对称官能化反应提供了新思路。
该研究工作得到国家自然科学委杰出青年基金(21225210)和重点项目(21532009)、中科院、科技部和上海市科委的支持。
