上海有机所交叉中心发现蛋白激酶RIPK1对饥饿应激的代谢调控机制
文章来源:上海有机化学研究所 | 发布时间:2021-10-26 | 【打印】 【关闭】
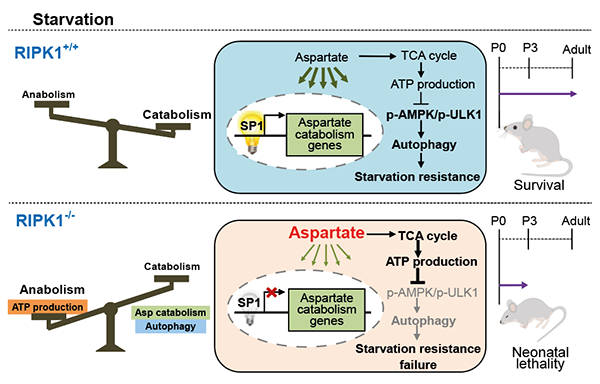
饥饿应激在哺乳动物新生儿存活、肿瘤微环境及缺血再灌注等一系列生理和病理过程中发挥着重要的作用。代谢调控对于饥饿条件下细胞及机体维持能量稳态及存活非常关键。蛋白激酶RIPK1是细胞存活与死亡的重要调控因子。早在1998年就发现了RIPK1缺失的小鼠会在出生后1-3天内死亡,但分子机制一直不明确。新生小鼠刚出生后,由于脱离了母体营养的供应,处于严重的饥饿状态。在正常情况下,新生儿会启动细胞自噬等代谢反应以抵御饥饿直到获取新的营养供给。RIPK1缺失小鼠的出生致死表型提示RIPK1对饥饿应激调控至关重要。
2021年10月22日,中国科学院上海有机化学研究所生物与化学交叉研究中心朱正江课题组在Nature Communications上发表最新研究成果“RIPK1 regulates starvation resistance by modulating aspartate catabolism”。 此项研究发现蛋白激酶RIPK1的一个新的代谢调控功能。该工作通过代谢组学和代谢流分析技术,发现RIPK1缺失条件下,代谢物天冬氨酸会在饥饿的细胞和组织内累积,进而抑制了AMPK信号通路及细胞自噬,使得细胞饥饿应激调控障碍并影响机体存活。
朱正江团队运用前期发展的代谢组学技术系统表征了RIPK1缺失条件下,细胞和组织上的代谢异常变化,发现天冬氨酸代谢通路和天冬氨酸水平在RIPK1缺失的细胞及小鼠组织中均显著上调。进一步通过代谢流分析技术发现,在RIPK1缺失细胞中,上调的天冬氨酸选择进入三羧酸循环(TCA cycle)通路中,并提升TCA活性和能量代谢物ATP的生成。细胞能量代谢分析结果也显示,RIPK1缺失及天冬氨酸处理都会导致细胞氧化磷酸化及ATP生成增加,而对糖酵解活性无显著影响。深入的分子机制研究表明,RIPK1的缺失使得天冬氨酸水平上升,进而降低AMP/ATP比例,抑制AMPK信号通路和细胞自噬,从而导致饥饿条件下的饥饿应激调控障碍。
图1. 蛋白激酶RIPK1对饥饿应激的代谢调控机制(图片来源:Nature Communications)。
为进一步揭示RIPK1调控天冬氨酸代谢的分子机制,研究者通过转录组分析发现了RIPK1缺失显著下调了多个天冬氨酸分解代谢酶。转录因子预测分析结果显示SP1是天冬氨酸分解代谢酶的共同调控因子。后续分子机制研究揭示RIPK1缺失下调转录因子SP1的磷酸化,抑制了SP1的核定位,从而导致SP1转录活性降低。有意思的是,RIPK1 虽然与SP1 有细胞内互作关系,但是RIPK1对于SP1转录活性的调控不依赖其激酶活性。最后,在细胞饥饿应激条件下,抑制天冬氨酸合成代谢或者过表达转录因子SP1,都能降低细胞内天冬氨酸水平,进而促进细胞在饥饿条件下应激调控,提升细胞存活度。此项研究发现了蛋白激酶RIPK1的一个新的代谢调控功能,解释了RIPK1缺失导致的出生致死表型的分子机制,为RIPK1、自噬及饥饿应激异常引起相关疾病的分子机制研究和治疗提供了新的思路。
中国科学院上海有机化学研究所生物与化学交叉研究中心为本工作第一单位,朱正江研究员为本文的通讯作者,梅馨予博士、郭远博士、谢章丹同学为论文的共同第一作者。该工作受到了交叉中心袁钧瑛院士、刘南研究员、许代超研究员、李盈副研究员的指导和支持,同时得到了国家自然科学基金委、上海市科委、中国科学院和同济大学附属杨浦医院临床研究与转化医学中心的支持。