炎症性肠病(Inflammatory bowel disease, IBD)主要包括溃疡性结肠炎(ulcerative colitis,UC)和克罗恩病(Crohn's disease,CD),是一类病因尚未明确的慢性、非特异性肠道炎症性疾病,具有不可治愈、终身复发性及可致残性等特点。近年来,我国IBD发病率逐年上升,而目前主要通过免疫调节剂、糖皮质激素等来缓解IBD患者的炎症反应,或通过手术切除胃肠道受损部分,尚无有效的IBD治疗药物。
GPR35是一类在胃肠道高度表达的G蛋白偶联受体,其在调节胃肠道稳态中发挥关键作用,与炎症过程、疼痛和胃癌的发生发展密切相关。据研究报道,GPR35的信号下调与IBDs密切相关,其T108M突变体显著增加IBDs的致病风险,因此,GPR35又被认为是治疗IBD的潜力药物靶标之一。GPR35生理状态下可被色氨酸、代谢性犬尿酸、5-羟基吲哚乙酸、溶血磷脂酸以及趋化因子CXCL17等激活。由于这些配体的激活能力较弱,GPR35目前仍被定义为孤儿受体。抗过敏药物(如洛度沙胺等)亦能够高效激活GPR35,但其识别和调控GPR35的作用机制尚不明确。
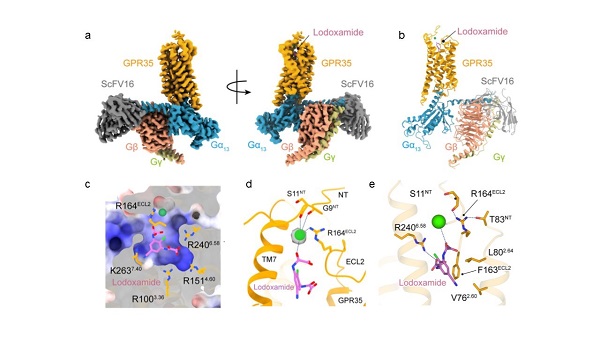
2022年12月21日,中国科学院上海药物研究所徐华强团队联合临港实验室蒋轶研究员,共同在Cell Discovery发表了最新的研究成果“Insights into divalent cation regulation and G13-coupling of orphan receptor GPR35”。研究团队解析了结合洛度沙胺的GPR35与下游G13蛋白的复合物冷冻电镜结构,分辨率为3.2埃(图1)。该成果首次揭示了GPR35特殊的极性正电结合口袋,并鉴定了二价金属离子的新结合位点和别构调控模式,阐明了洛度沙胺识别和激活GPR35的分子机制。研究进一步揭示了IBD相关突变T108M和V76M对GPR35活性的调控机制,鉴定了受体与G13蛋白互作界面的蛋氨酸口袋,揭示了GPR35选择性识别G13蛋白的分子机制。这些成果加深了对GPR35配体识别和功能调控基础生物学问题的理解,也为靶向GPR35的IBD治疗药物设计奠定了结构基础。
本研究中的冷冻电镜数据由中国科学院上海药物研究所高峰电镜中心收集。上海药物研究所段佳博士、上海药物研究所博士后刘秋枫,以及高峰电镜中心执行主任袁青宁为该论文的共同第一作者。蒋轶研究员和徐华强研究员为共同通讯作者,上海药物所为第一完成单位。该工作获得了包括国家自然科学基金委、科技部重大专项,以及上海市市级科技重大专项等资金的资助。
图1:a-b,洛度沙胺与GPR35和G13蛋白复合物结构;c,GPR35的极性正电结合口袋;d,二价离子与受体以及洛度沙胺的相互作用界面;e, GPR35与洛度沙胺的相互作用界面细节。
(供稿部门:徐华强课题组)