急性髓系白血病(acute myeloid leukemia,AML)是由骨髓、外周血或髓外组织中的髓样原始细胞异常增生导致的一种恶性血液肿瘤。近年来,AML发病率和耐药突变持续上升,其中FLT3突变是AML中最常见的基因突变,约占30%(Leukemia, 2019, 33: 299-312)。FLT3-ITD突变是AML患者的独立预后不良因素之一,具有易复发、生存时间短的特点,且对传统化疗响应不佳。靶向抑制FLT3是抗FLT3突变AML的重要手段,米哚妥林(midostaurin)、吉列替尼(gilteritinib)和奎扎替尼(quizartinib)等FLT3抑制剂已在美国或日本批准上市,但FLT3抑制剂用药后的适应性及获得性耐药是目前临床亟需解决的关键问题。
基于上述挑战,中国科学院上海药物研究所、中科中山药物创新研究院李佳课题组联合浙江大学药学院刘滔课题组于2022年12月16日在Leukemia杂志发表了最新研究成果“Dual inhibition of CHK1/FLT3 enhances cytotoxicity and overcomes adaptive and acquired resistance in FLT3-ITD acute myeloid leukemia”。该成果首次提出并验证了双靶向CHK1/FLT3能够克服FLT3抑制剂耐药,是一种克服AML患者对FLT3抑制剂治疗适应性和获得性耐药的新策略,并开发出具有良好成药性的双靶向CHK1/FLT3抑制剂候选药物30(TLX83)。
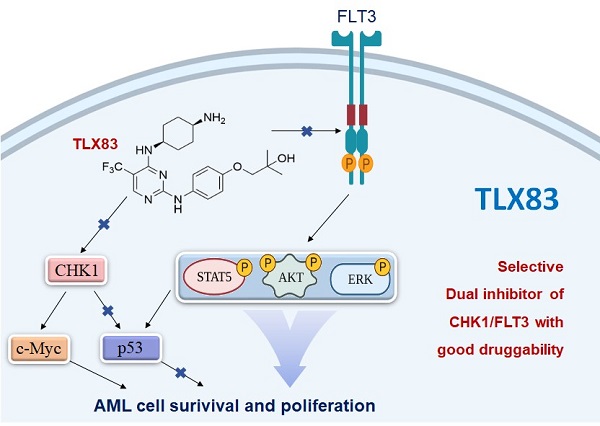
本研究基于CHK1抑制剂与FLT3抑制剂联用具有协同增效及对抗适应性耐药的潜力,提出双靶向抑制CHK1/FLT3的创新药物研发概念,并确定了双靶向抑制FLT3/CHK1的临床前候选分子TLX83,它不仅能够强效抑制多种FLT3获得性突变细胞生长、对抗细胞因子诱导的适应性耐药,而且能够显著提高多种FLT3突变AML荷瘤小鼠生存期。机制研究显示,TLX83能显著抑制FLT3与CHK1相关通路,下调c-Myc通路,并显著激活p53通路;p53敲除显著逆转TLX83对抗适应性耐药的能力,表明p53通路激活在TLX83克服FLT3抑制剂适应性耐药中起着重要作用。
TLX83成药性良好,在包括人在内的多种种属肝微粒体中代谢稳定,小鼠、大鼠以及犬口服药物代谢性质良好,无明显骨髓抑制等血液毒性,具有较好安全窗。目前正在对TLX83开展全面的系统临床前研究,预计2023年申报临床。
中科院上海药物所、中科中山药物创新研究院周宇波研究员、李佳研究员和浙江大学刘滔副教授为论文共同通讯作者,中科中山药物创新研究院助理研究员姜凯龙博士、副高级实验师胡小蓓、浙江大学药学院博士研究生李学梅以及上海药物所中级工程师王畅为共同第一作者。该工作获得了广东省高水平新型研发机构、广东省高水平创新研究院、国家自然科学基金委、浙江省自然科学基金委、上海市科学技术委员会等经费的资助。
文章链接:https://www.nature.com/articles/s41375-022-01795-8
(供稿部门:李佳课题组)