Cellular & Molecular Immunology|上海免疫与感染研究所孟广勋课题组揭示单核细胞替代性NLRP3炎症小体激活的负调控机制
文章来源:上海免疫与感染研究所 | 发布时间:2023-08-28 | 【打印】 【关闭】
8月17日,中国科学院上海免疫与感染研究所孟广勋课题组在学术期刊Cellular & Molecular Immunology在线发表了研究论文“cFLIPs regulates alternative NLRP3 inflammasome activation in human monocytes”。
生理性炎症对机体免疫至关重要,但不受控制的炎症可能导致组织损伤和自身免疫性疾病。适当程度的免疫反应是宿主对微生物感染做出反应所必需的。负调控机制的存在可以避免过度的炎症反应对组织和整个机体造成不可逆转的损害。虽然目前对于经典型(Canonical)和非经典型(Non-canonical)NLRP3炎症小体激活的负调控机制已经有了较多的研究,但人单核细胞中非传统型(Alternative)NLRP3炎症小体激活强度的调控机制还没有报道。
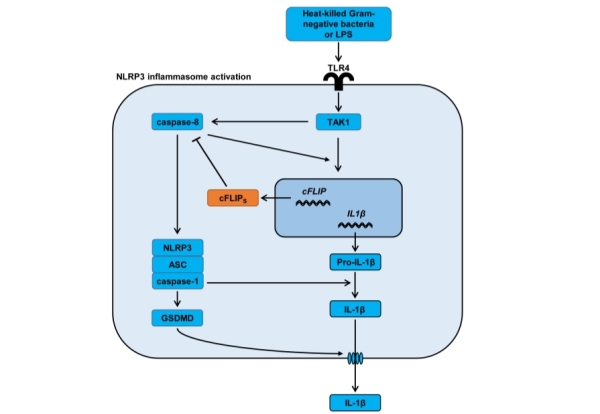
在LPS的作用下,人单核细胞通过TLR4-TRIF-caspase-8通路介导下游非传统型NLRP3炎症小体的激活。在本研究中,研究者发现非传统型NLRP3炎症小体的激活强度在几小时内就会达到最大值,后续阶段维持不变。在机制上,灭活革兰氏阴性菌刺激诱导单核细胞NF-kB通路的激活,这使细胞caspase-8样抑制蛋白(cFLIP)表达上调。上调的短亚型cFLIP (cFLIPs) 通过靶向caspase-8,并抑制caspase-8持续切割,从而阻止了下游NLRP3炎症小体的过度活化。实验数据表明,cFLIP编码基因( cFLAR)的缺失会导致过度炎症反应的发生。因此,cFLIPs的表达上调是人单核细胞维持非传统型NLRP3炎症小体有限性激活不可或缺的分子事件之一。
图例 cFLIPS负调控单核细胞中非传统型(Alternative)炎症小体激活
该项研究工作主要由上海大学与上海免疫与感染研究所联合培养硕士研究生高玉辉、上海免疫与感染研究所出站博士后喻实(现广州实验室)完成,上海免疫与感染研究所孟广勋研究员、上海大学生命科学学院魏滨教授为论文的通讯作者。该研究得到中国博士后科学基金、国家自然科学基金、上海市、科技部、中国科学院的经费支持。
原文链接:https://pubmed.ncbi.nlm.nih.gov/37591930/