肿瘤微环境(TME)是指由肿瘤细胞、免疫细胞等多种细胞与各种信号分子所构成的复杂生态系统,并随着肿瘤进程发生变化。免疫检查点抑制剂如PD-1/PD-L1抗体通过恢复肿瘤杀伤性CD8 +T细胞功能,提高肿瘤微环境中CD8 +T细胞数量与活性,从而提高机体免疫监察能力发挥抗肿瘤效应。尽管这种治疗方式使得部分病人能够获得长期生存受益,在肿瘤治疗领域取得了重大成功,但是肿瘤病人肿瘤微环境复杂多变的特性常常导致肿瘤浸润的CD8 +T细胞数量不足或丧失活性,从而使超过70%的肿瘤病人无法有效响应免疫检查点疗法即对免疫检查点抑制剂产生了先天性耐药或者获得性耐药。由于免疫检查点疗法的耐药性问题极大地限制了该疗法的临床应用,所以,如何克服免疫检查点抑制剂耐药性问题成为肿瘤免疫研究的热点问题。
为了发现能够调节肿瘤微环境中CD8 +T抗肿瘤免疫的新靶点,为克服免疫检查点抑制剂耐药性提供新的策略与思路,中国科学院上海药物研究所罗成课题组联合哈尔滨工业大学刘川鹏课题组,发展了基于转录组数据预测肿瘤免疫调控靶标的计算生物学方法,并发现精氨酸甲基转移酶1(PRMT1)是调控黑色素肿瘤微环境中CD8 +T细胞浸润与活化的新靶标,且实验室自主研发的PRMT1小分子抑制剂能够显著提高肿瘤微环境中CD8 +T细胞的数量与活性,抑制肿瘤生长并提高耐药黑色素瘤对PD-1抗体治疗的敏感性。该研究论文于2023年11月22日在线发表于 Cancer Research。

前期研究中,罗成课题组围绕表观遗传调控蛋白先导化合物发现和化学干预研究开展系统研究,针对蛋白精氨酸甲基转移酶家族PRMT1、PRMT4、PRMT5、PRMT6蛋白获得了一系列高活性、高选择性、母核结构全新的小分子抑制剂(J Med Chem. 2012;55:7978;J Med Chem. 2017;60:8888.;J Med Chem. 2017;60:6289),并以自主研发的PRMT1、PRMT5小分子为化学探针揭示了PRMT家族在肿瘤干性调控、肿瘤耐药调控方面的全新功能,为PRMT1、PRMT5抑制剂的临床适应症应用拓展提供了重要科学依据。此外,团队与海军军医大学附属长征医院谢渭芬主任合作,发现PRMT5抑制剂通过下调肝细胞核因子HNF4 转录降低肝癌干性相关基因表达,具有抗肝癌生长活性(Theranostics. 2019,13;9(9):2606-2617)。与上海交通大学医学院附属仁济医院张进主任合作发现PRMT1抑制剂可克服肾透明细胞癌一线药物舒尼替尼耐药,揭示PRMT1调控耐药逃逸通路LCN2-pAKT-pRb激活、导致舒尼替尼耐药的表观遗传机制,并提出PRMT1抑制剂克服肾癌耐药的联用治疗新策略(Theranostics. 2021,11(11):5387-5403)。与中国科学院分子细胞科学卓越创新中心高栋研究员合作,发现代谢物精胺抑制去势抵抗性前列腺肿瘤生长并克服恩杂鲁胺耐药的新功能,揭示代谢物作用于表观遗传靶标PRMT1调控肿瘤耐药的表观遗传分子机制,并提出PRMT1抑制剂可作为去势抵抗性前列腺肿瘤治疗的新策略(Cell Rep. 2023,42(7):112798)。近年来,课题组通过开展肿瘤免疫调控新靶标和小分子研究,发现了代谢物L-5-羟基色氨酸抑制PD-L1/L2表达而激活T细胞抗肿瘤免疫的新功能,为L-5-HTP应用于癌症免疫治疗以及改善肿瘤患者的抑郁行为提供了理论依据(J Immunother Cancer. 2022,10(6):e003957),发现了可调控髓系抑制细胞MDSC提高放疗和放疗免疫检查点联合治疗效果的“m6A阅读子”YTHDF2小分子抑制剂(Cancer Cell. 2023,41(7):1294-1308)。
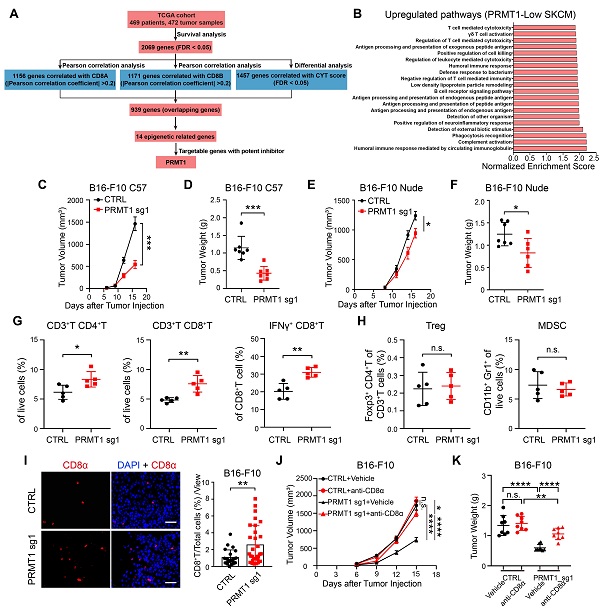
在前期研究基础上,团队综合表达了差异、生存分析、CD8 +T细胞相关性分析、免疫活细胞杀伤性评分(CYT)等序贯筛选,发展了肿瘤杀伤性T细胞调控靶标预测的计算生物学方法,并基于TCGA数据库469位黑色素瘤患者基因表达谱进行分析和筛选,发现了抑制黑色素肿瘤微环境内CD8 +T细胞浸润与激活的潜在新靶标PRMT1。团队经过进一步动物水平功能评价,确证了PRMT1敲除显著降低同系免疫完整小鼠上黑色素肿瘤内的CD8 +T细胞数量和IFN +CD8 +T比例,延缓肿瘤生长,而在免疫缺陷荷瘤小鼠上PRMT1敲除对肿瘤生长的抑制作用显著降低。同系免疫完整小鼠模型上,CD8 +T细胞中和抗体显著降低了PRMT1敲除的肿瘤生长抑制作用。表明敲除黑色素细胞内源PRMT1能够增加肿瘤组织内CD8 +T细胞与活性,并以CD8 +T细胞依赖的方式发挥显著的抗肿瘤效应。
图1. PRMT1抑制黑色素瘤微环境中T细胞的浸润与激活
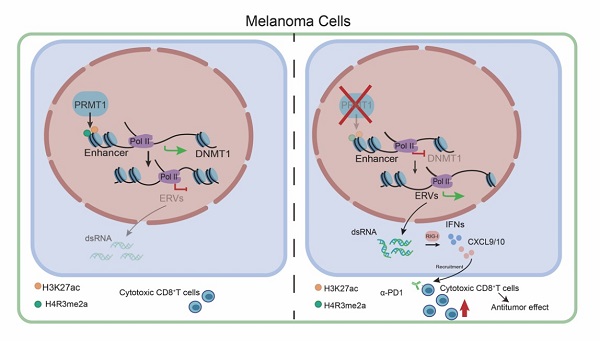
结合转录组与染色质免疫共沉淀组分析,机制研究发现敲除黑色素细胞内PRMT1能够降低DNA甲基转移酶1(DNMT1)基因的增强子区域H4R3me2a与H3K27ac修饰水平,抑制增强子活性,降低DNMT1的转录表达。下调的DNMT1进一步激活了肿瘤细胞内逆转录病毒元件(ERVs)的转录表达,并促进ERV来源的双链RNA(dsRNA)在细胞质内累积,进而激活dsRNA识别通路与I型干扰素通路,最终促进I型干扰素下游的T H1型趋化因子CXCL9/10/11的表达。T H1型趋化因子被报道能够有效的招募CD8 +T细胞至肿瘤组织内部并促进CD8 +T细胞的激活。至此,该研究阐明了PRMT1调控黑色素肿瘤微环境内CD8 +T细胞浸润与激活的表观遗传分子机制。
图2 PRMT1调控DNMT1-ERVs-dsRNA-IFNs信号通路模式图
最终,运用自主开发的PRMT1的抑制剂DCPT1061,研究团队评估了PRMT1抑制剂联合免疫检查点抑制剂PD-1抗体在低免疫原性、PD-1抗体治疗不响应的黑色素肿瘤模型中的抗肿瘤效应。结果表明,在对免疫检查点抑制剂治疗原发性耐药的B16-F10黑色素肿瘤上,PRMT1抑制剂DCPT1061增加肿瘤浸润CD8 +T细胞的数量与活性,提高耐药黑色素瘤对PD-1抗体治疗的敏感性。
综上所述,该研究开发了肿瘤杀伤性T细胞调控靶标预测的计算生物学方法,发现了PRMT1是黑色素肿瘤微环境CD8 +T细胞浸润和活性调控的重要靶标,阐明了表观修饰酶PRMT1参与CD8 +T细胞相关肿瘤免疫调节的全新功能与表观遗传分子机制,提示了PRMT1抑制剂在肿瘤免疫治疗、克服免疫检查点抑制剂耐药方面的应用前景。
上海药物所与哈尔滨工业大学联合培养博士研究生陶泓儒、南京中医药大学硕士研究生金晨、中国科学院杭州高等研究院硕士研究生周礼源及上海交通大学附属新华医院主治医师邓振忠为该论文的共同第一作者。上海药物所罗成研究员、张元元研究员和哈尔滨工业大学的刘川鹏副教授为该论文的共同通讯作者。该研究还得到了中国科学院广州生物医药与健康研究院孔祥谦研究员、德国海德堡大学卢俊彦教授、浙江理工大学叶飞教授的支持,得到国家重点研发计划、国家自然科学基金、上海市自然科学基金等项目的资助。