分子细胞科学卓越创新中心邹卫国组合作发现NSD1-OSR2是潜在的骨关节炎靶标
文章来源:分子细胞科学卓越创新中心 | 发布时间:2023-12-05 | 【打印】 【关闭】
11月27日,国际学术期刊Cell Death & Differentiation在线发表了中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)邹卫国研究组与上海市第六人民医院张长青教授合作论文“H3K36 methyltransferase NSD1 protects against osteoarthritis through regulating chondrocyte differentiation and cartilage homeostasis”。该论文系统研究了表观遗传修饰组蛋白H3K36甲基化在骨关节炎中的作用及其分子机理,为骨关节炎的治疗提供了多个靶点。
邹卫国研究员团队关注多个表观遗传因子在骨骼退行性病变中的功能及分子机理,其中包括组蛋白H3K4去甲基化酶LSD1在骨质疏松症中的作用及骨折损伤修复中的功能及分子机制(2018,Bone Research;2020,Science Advances);组蛋白H3K36三甲基转移酶SETD2在骨髓间充质干细胞命运决定的分子机制(2018,PLoS Biology);组蛋白H3K36一甲基二甲基转移酶NSD1在软骨与骨发育中的分子机制(2021,Bone Research)等。既往研究中发现NSD1调控Sox9的表达,在骨骼发育和骨骼损伤修复中发挥了重要功能(2021,Bone Research)。本论文延续发现NSD1在关节软骨细胞中调节转录因子OSR2的表达,在关节软骨稳态和代谢中发挥重要功能。本研究为骨关节炎的治疗提供了多个靶点,具有创新的分子机制和临床应用价值。
骨关节炎(Osteoarthritis,OA)是最常见的关节疾病,目前尚无有效的针对疾病病因的药物,其病理机制有待进一步研究。邹卫国研究团队发现在衰老软骨细胞和与年龄相关的骨关节炎软骨中,H3K36三种甲基化均减少。团队采用Prrx1-Cre诱导的H3.3K36M转基因小鼠,实现H3K36三种甲基化降低,发现小鼠表现出关节软骨破坏和骨赘形成等典型骨关节炎表型。用Prrx1-Cre诱导条件性基因敲除三种不同的H3K36甲基转移酶,发现Nsd1Prrx1-Cre小鼠复制了K36M/+Prrx1-Cre小鼠的表型,而Nsd2Prrx1-Cre或 Setd2Prrx1-Cre小鼠的关节软骨则没有表现出骨关节炎表型。免疫染色结果显示,Nsd1Prrx1-Cre小鼠的软骨细胞合成代谢活性降低,分解代谢活性升高,软骨分化减弱。转录组和ChIP-seq数据显示,Osr2是受Nsd1调控的一个关键因子。关节腔内递送Osr2腺病毒能有效改善Nsd1Prrx1-Cre小鼠关节软骨的稳态。在人类骨关节炎软骨中,NSD1和OSR2的mRNA和蛋白水平均有所下降。研究结果表明,NSD1诱导的H3K36甲基化和OSR2表达在关节软骨稳态和骨关节炎中发挥着重要作用。因此,H3K36甲基化和OSR2将是治疗骨关节炎的一种新的策略。
上海市第六人民医院邵瑞博士、索金龙博士和中国科学院分子细胞科学卓越创新中心张中博士为该论文共同第一作者,邹卫国研究员和国家骨科医学中心/上海市第六人民医院张长青教授为该论文共同通讯作者。该项工作得到了国家重点研发计划、国家自然科学基金、中国科学院战略性先导科技专项、中国科学院稳定支持基础研究领域青年团队计划、上海骨骼系统变性与再生前沿科学中心等基金项目的资助。感谢中国科学院分子细胞科学卓越创新中心分子生物学技术平台、细胞分析技术平台及动物实验技术平台对本研究的大力支持。
文章链接:https://www.nature.com/articles/s41418-023-01244-8
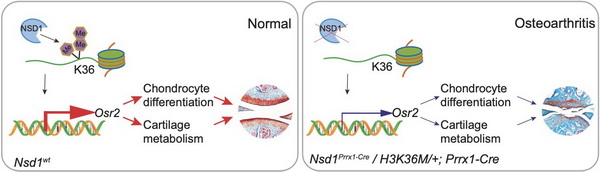
左图:组蛋白H3K36甲基转移酶NSD1在软骨细胞中上调Osr2基因的表达,有利于软骨细胞分化与关节软骨稳态
右图:NSD1基因敲除导致组蛋白H3K36甲基化降低,导致骨关节炎
