曾艺组与陈剑峰组合作揭示:微环境炎症信号调控周期性乳腺再生,并保护干细胞免受细胞毒性应激损害
文章来源:分子细胞科学卓越创新中心 | 发布时间:2023-12-26 | 【打印】 【关闭】
12月22日,国际学术期刊Cell Stem Cell在线发表了中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)曾艺研究组和陈剑峰研究组的最新合作研究成果“Niche inflammatory signals control oscillating mammary regeneration and protect stem cells from cytotoxic stress”。该研究发现了乳腺干细胞与免疫微环境细胞新的相互作用,揭示了乳腺干细胞具有更强的生存能力和化疗耐药性的分子机制。
研究人员首先发现了在生理周期中,由于乳腺组织的微环境中发生的细胞凋亡的增多和减少,会引起有节律地、反复地自限性炎症规律。通过单细胞转录组分析、体外共培养实验、体内谱系示踪实验和遗传学基因敲除实验,研究人员发现细胞凋亡引起组织驻留的CD11c+巨噬细胞的激活,分泌IL1 ,从而激活Procr+干细胞的IL1R1-NF- B信号通路活性。微环境中的细胞凋亡增多时,组织中的Procr+干细胞的NF- B信号通路活性上调,一方面促进生存,另一方面抑制分化。相反,微环境中的细胞凋亡减少时,Procr+干细胞的NF- B信号通路下调,干细胞启动分化程序,产生后代细胞,表现为产生更高比例的管腔细胞 (管腔细胞在生理周期的形态变化中更容易发生凋亡和被损耗)。在正常生理状态下,组织干细胞随着生理周期的节律进行周期性地NF- B信号通路活性震荡,产生的后代细胞贡献于组织器官的稳态维持和再生。在病理状态下,例如在使用化疗药物紫杉醇时,组织中更多的细胞死亡,引起CD11c+巨噬细胞活动增加,其与Procr+干细胞的交流增强,赋予了干细胞更强的存活能力,即干细胞在细胞毒性应激条件下存活,表现为化疗耐药性。最后,研究人员使用小分子化合物抑制IL1R1,可以阻断巨噬细胞与干细胞的互作,降低干细胞在应激条件下的NF- B活性,提高了干细胞对紫杉醇治疗的敏感性。
该研究揭示了干细胞为何具有更强的生存能力,为何具有化疗耐药性的分子机制,对开发靶向肿瘤干细胞治疗策略,具有潜在的重要意义;发现了Procr+干细胞与免疫微环境细胞新的互作,并揭示了干细胞主动调控其免疫微环境的能力。
国科大杭州高等研究院/分子细胞卓越中心博士后刘春业为本文第一作者。分子细胞卓越中心曾艺研究员和陈剑峰研究员为该论文的共同通讯作者。该研究得到多伦多大学许志忠教授大力帮助,得到分子细胞卓越中心公共技术服务中心动物实验技术平台、细胞分析技术平台和分子生物学技术平台支持。该项工作获得科技部项目、中国科学院先导项目、国家基金委和新基石基金项目的大力资助。
文章链接:https://www.sciencedirect.com/science/article/pii/S1934590923004290?via%3Dihub
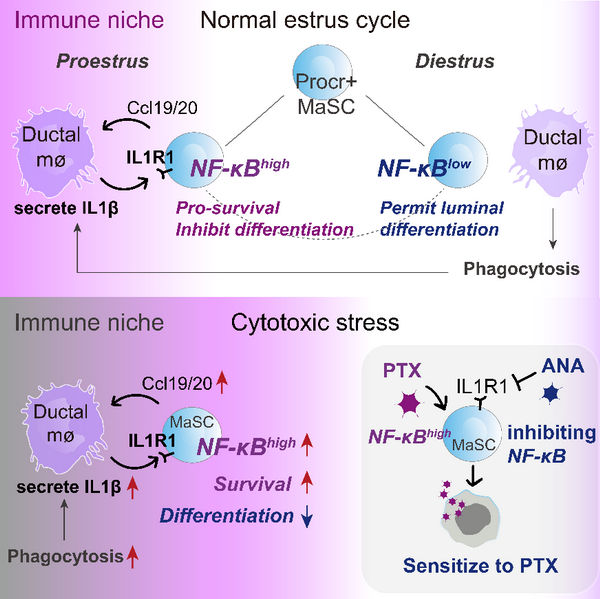
乳腺干细胞与免疫微环境细胞的相互作用示意图
