胡红雨组揭示Ataxin-2蛋白通过募集RNA解旋酶DDX6影响细胞P-body稳态的分子机制
文章来源:分子细胞科学卓越创新中心 | 发布时间:2024-06-28 | 【打印】 【关闭】
5月27日,Journal of Biological Chemistry正式发表了中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)胡红雨研究组的研究论文:“PolyQ-expanded ataxin-2 aggregation impairs cellular processing-body homeostasis via sequestering the RNA helicase DDX6”。该研究揭示了多聚谷氨酰胺(Polyglutamine, PolyQ) 延伸和RNA结合是II型脊髓小脑共济失调蛋白Ataxin-2 (Atx2) 发生积聚的关键因素,发现Atx2积聚物通过募集RNA解旋酶DDX6到包涵体中,从而损坏细胞质中P-body的组装与稳态并加重前体mRNA的错误剪接。
蛋白质积聚(Aggregation) 是一个普遍的生物学过程,蛋白质错误折叠进而形成不溶性的淀粉样积聚物(Aggregates) 是多种神经退行性疾病的重要病理特征。不同于液滴状态的凝结物(Condensates),蛋白质积聚物通常表现出致病性的特征,如溶解度降低和生物活性丧失。随着研究的深入,人们在多种神经退行性疾病患者的脑组织中检测到多种RNA结合蛋白的积聚物,它们与神经退行性疾病的关联也逐渐被人们所关注。
Atx2是一种N-端含有一段22-23个连续谷氨酰胺的RNA结合蛋白,在细胞中发挥多种功能,包括参与RNA的转录后加工和翻译、脂质代谢、Ca2+离子的稳态平衡以及内质网的动态性调控。研究发现,PolyQ序列的扩增会导致自身发生积聚,而Atx2的积聚与脊髓小脑共济失调II型(SCA2) 以及肌萎缩侧索硬化症(ALS) 等多种神经退行性疾病密切相关。因此,有关Atx2的积聚和募集作用以及致病性是值得深入探讨的科学问题。
在该研究中,研究人员通过生化实验和细胞免疫荧光实验探究了PolyQ延伸的Atx2所形成的积聚物的特性。研究发现,PolyQ的延伸能引起Atx2发生积聚,Atx2的积聚物会通过特定序列RNA的参与募集DDX6到包涵体中,引起可溶性DDX6的减少。而细胞质中DDX6量的减少损坏了P-body的组装和稳态,从而使P-body中包含的核酸内切酶MARF1释放到细胞质中,导致下游靶向mRNA的降解和蛋白质翻译水平的下降。另一方面,可溶性DDX6的减少也会影响剪接因子在细胞核与细胞质之间的穿梭过程,加重前体mRNA的错误剪接。该研究揭示了Atx2积聚和募集作用的分子机制,对于深入理解蛋白质积聚致病的病理机制具有重要意义,同时为治疗相关疾病提供了新的研究思路。
分子细胞卓越中心博士研究生王健洋为该文第一作者,胡红雨研究员为通讯作者。感谢分子细胞卓越中心细胞技术平台的大力支持。该工作得到了国家基金委和中国科学院项目的经费资助。
文章链接:https://doi.org/10.1016/j.jbc.2024.107413
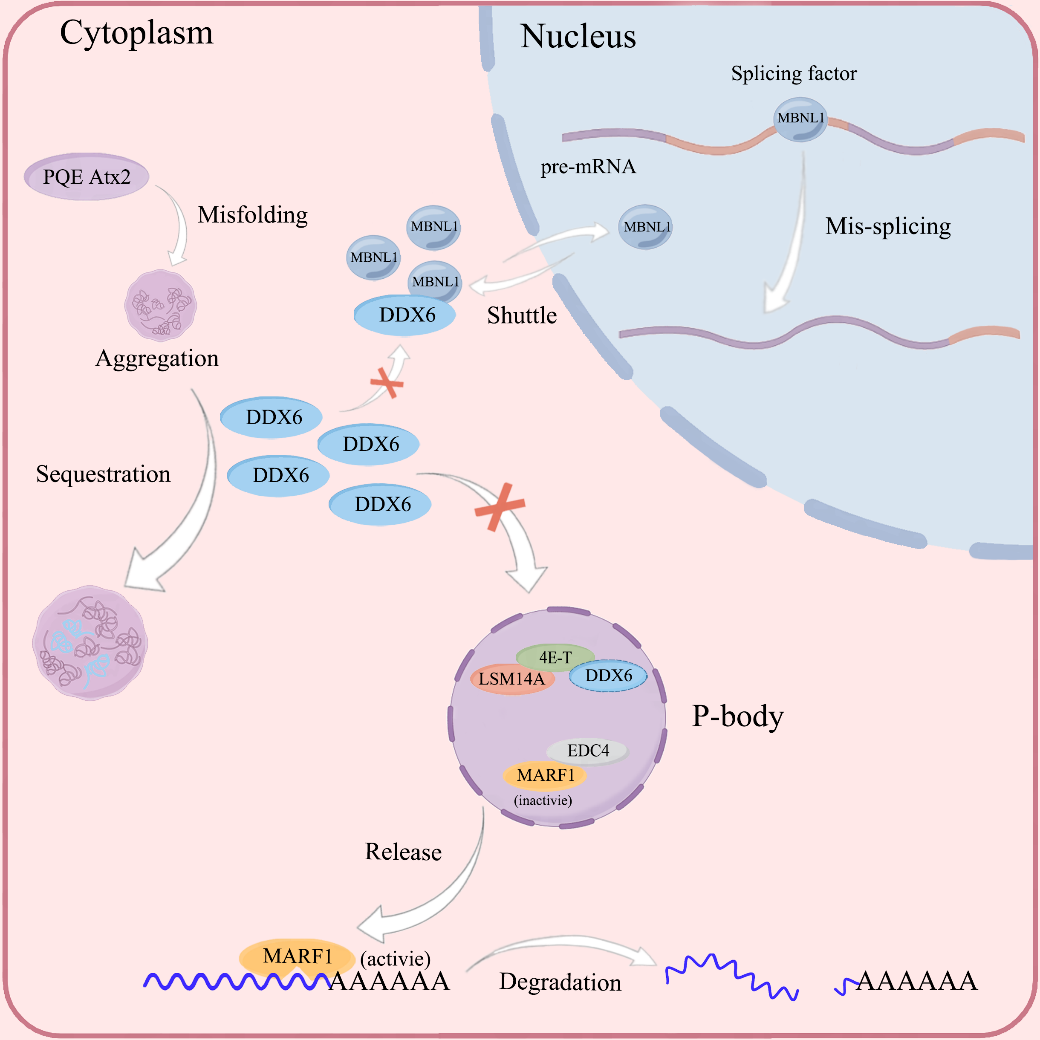
Atx2的积聚和募集作用及致病的分子机制
PolyQ延伸突变的Atx2在细胞中发生错误折叠形成积聚物,该积聚物募集细胞质中的DDX6,导致细胞中可溶性DDX6的减少。DDX6量的减少损坏了细胞质中P-body的组装与稳态,并加重前体mRNA的错误剪接。P-body结构的损坏会引起其中的核酸内切酶MARF1释放到细胞质中,导致了下游靶向mRNA的降解和蛋白质翻译水平的下降
