上海有机所交叉中心团队发现微管稳定剂可以干预重复性脑损伤诱导的阿尔茨海默病相关病理发生及神经退行性病变
文章来源:上海有机化学研究所 | 发布时间:2023-09-18 | 【打印】 【关闭】
有一大类神经退行性疾病,包括AD, CTE以及额颞叶变性(Frontotemporal lobar degeneration, FTLD)等,均以富集于轴突的微管结合蛋白tau的病理性沉积为特征,这类疾病也被统称为tau蛋白病(tauopathy)。在这些疾病的发病过程中,tau蛋白会发生异常的错误折叠,形成病理性的多聚体结构,并进一步招募更多生理性正常tau蛋白形成稳定的病理性纤维,继而以类似朊蛋白的模式在脑内的扩散传播。这些具备模板作用和自我扩增能力的tau蛋白被视为病理发生过程中的“种子”。Tau蛋白的病理传播程度和范围与神经退行性疾病的发展进程密切相关,但是调控这一过程的机制尚不清楚。tau蛋白病理种子是如何形成的,有哪些因素引发或促进了tau蛋白病理发生,是AD及相关神经退行性疾病研究领域的一个核心问题。
与此同时,大多数tau蛋白病为散发性,没有明显的家族性遗传致病突变。但CTE常见于经历过rTBI的个体中,其组织病理学与AD和FTLD患者形似,临床证据提示TBI与包括AD在内的多种tau蛋白病的病理发生机制具有关联性。
在研究中,研究人员改进发展了新型的rTBI小鼠模型,在常用的tau蛋白疾病模型小鼠PS19中观察到了类似人类脑中的病理特征,如胶质细胞激活,神经元和轴突损伤等。在研究TBI的发病机制时,研究人员发现经TBI处理后,老年而不是年轻PS19小鼠会表现出显著的神经元胞体纤维缠结(Neurofibrillary tangles, NFT)状的tau蛋白病理。进一步实验发现,年老而非年轻的PS19小鼠脑内已经可以检测到不可溶的磷酸化tau蛋白,提示已经有病理“种子”产生(图1)。于是假设TBI可以促进病理种子“生根发芽”。
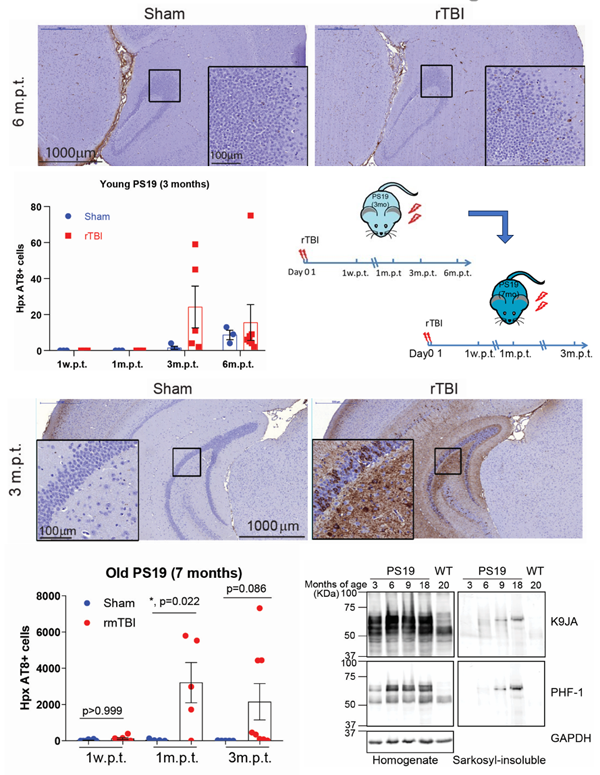
图1. rTBI在老年PS19小鼠而非年轻PS19小鼠中诱导NFT形成
于是在随后的研究中,研究人员采用预先注射的方式,分别在年轻PS19小鼠和WT小鼠脑内立体定位注射外源性tau蛋白种子,然后施加TBI处理加以验证,均得到了相同的结果,即TBI促进了tau病理蛋白的形成和传播。
进一步对未播种任何外源tau蛋白种子的WT小鼠进行TBI处理,发现在视神经束(optic tract),TBI处理诱导了tau病理蛋白产生及组织萎缩,说明神经病变的发生(图2)。
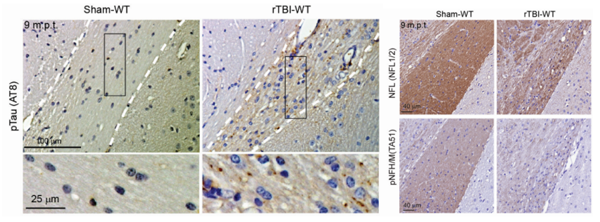
图2. rTBI在未播种任何病理tau蛋白种子的WT小鼠中诱导点状tau病理蛋白产生
这些验证有力地证明了TBI能够诱导Tau蛋白的异常聚集和传播。无论是外源性tau病理种子诱导的还是未播种tau蛋白种子的实验,都提供了关联TBI和tau蛋白相关疾病病理发生机理的证据。
研究人员接下来进一步发现,在脑外伤的早期阶段,尽管几乎无法检测到tau病理蛋白的存在,但微管完整性已经发生变化,使用能够透过血脑屏障的微管稳定剂可以修复微管损伤,从而减少TBI引起的tau蛋白病理的进一步发展(图3)。此外,长期使用这种稳定剂还可以挽救TBI诱导的神经变性,功能丢失(图4)。这些实验结果提示微管破坏可能是tau蛋白病理发生的上游事件,并在该病理发生过程中起着关键作用。

图3. rTBI破坏轴突微管
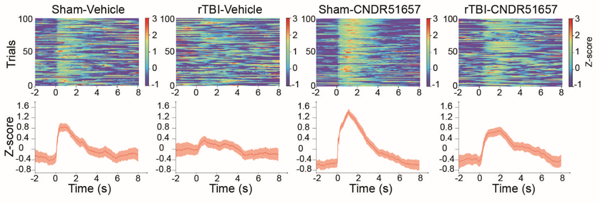
图4. 功能性实验验证rTBI引起的小鼠视神经功能异常可以被微管稳定剂挽救
这项研究的证明了TBI促进病理性tau蛋白的形成和神经退行性变化的发生,揭示了TBI与tau蛋白相关疾病之间的关联,提供了理解tau蛋白病病理发生机理的新角度。研究结果进一步阐明了微管损伤在这一过程中起着关键作用,提示了微管稳定性可能在调控tau蛋白异常聚集和传播过程中具有重要作用。该研究发现通过使用能够透过血脑屏障的微管稳定剂,能够减轻TBI引发的神经病理损伤,这为将微管稳定剂作为干预TBI相关的神经退行性疾病,如AD和CTE的潜在治疗策略提供了依据。
该论文以中国科学院上海有机化学研究所生物与化学交叉研究中心贺焯皓课题组的博士研究生赵心怡,曾文和宾夕法尼亚大学Virginia M.-Y. Lee课题组的徐弘助理教授为共同第一作者,贺焯皓研究员和Virginia M.-Y. Lee教授为本文共同通讯作者。中国科学院上海有机化学研究所生物与化学交叉研究中心何凯雯研究员,上海科技大学王彤教授,中国科技大学申勇教授等在本项研究过程中提供了宝贵的帮助。
该工作受到了国家自然科学基金委,中国科学院,和上海市科委等项目资助。
原文链接:http://www.science.org/doi/10.1126/scitranslmed.abo6889
