9月4日,国际学术期刊 The Journal of Biological Chemistry发表了中国科学院上海生命科学研究院生物化学与细胞生物学研究所胡红雨研究组的研究论文 “Aggregation of Polyglutamine-Expanded Ataxin-7 Specifically Sequesters Ubiquitin-Specific Protease 22 and Deteriorates Its Deubiquitinating Function in SAGA Complex”。该论文发现脊髓小脑共济失调症7型蛋白(Ataxin-7)可以通过特异的相互作用“挟持”去泛素化酶USP22,从而导致其功能受损。该研究揭示了脊髓小脑共济失调症7型蛋白致病的新机制, 解释了蛋白质积聚的细胞毒性和神经退行性, 为验证该研究组之前提出的“挟持模型” (Yang H, et al, Scientific Reports, 2014, 4, 6410) 提供了新的实验证据。
脊髓小脑共济失调症7型 (Spinocerebellar Ataxia 7,SCA7) 是由Ataxin-7蛋白的多聚谷氨酰胺(Polyglutamine, PolyQ)区域发生异常延伸而引起的一种神经退行性疾病。患者表现为行走困难、手灵巧度下降、言语障碍及失明等临床症状。Ataxin-7蛋白是转录共激活因子 SAGA 复合物的一个亚基。Ataxin-7蛋白的PolyQ延伸会使其错误折叠,并形成积聚沉淀物或包涵体;有关这些积聚物或包涵体是否会影响SAGA复合物的功能还不是很清楚。
研究组中的杨慧博士等研究人员发现PolyQ延伸的Ataxin-7可以将SAGA复合物中一个重要的去泛素化酶USP22 募集到不可溶的积聚物或包涵体中,而且该募集作用依赖于二者之间特异的相互作用。在SAGA复合物中,USP22的主要功能是负责组蛋白H2B 的去单泛素化,所以通过检测细胞中组蛋白H2B的单泛素化水平,可以推断PolyQ 延伸的 Ataxin-7对 SAGA复合物功能的影响。该研究结果显示,PolyQ 延伸的Ataxin-7降低了USP22 的去泛素化酶活性,显著增加细胞中单泛素化 H2B的水平,表明Ataxin-7的 PolyQ 延伸导致SAGA复合物中USP22 的去泛素化功能受损。该研究合理解释了SCA7 疾病中出现转录失调的原因,也为阐述SCA7疾病的病理机制提供了新的依据。
该项研究工作得到了国家科技部、基金委、中国科学院的经费支持;数据收集工作得到生化与细胞所公共技术服务中心的支持。
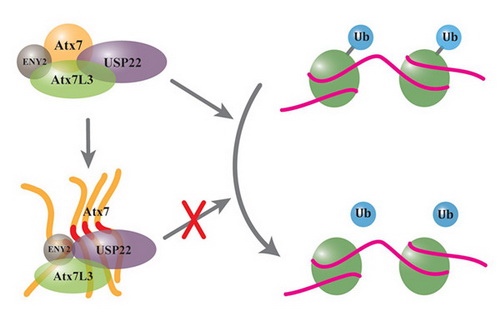
PolyQ延伸的Ataxin-7蛋白形成的积聚物或包涵体可以“挟持”去泛素化酶USP22到不可溶组分中,从而导致USP22将组蛋白H2B去单泛素化的功能受损。该模型解释了蛋白质积聚引起细胞毒性和神经退行性的原因。

