现有抗生素很难根治慢性细菌感染,主要原因是原本对抗生素敏感的致病菌进入了休眠状态。这些休眠的细菌被称作“持留菌”,除了保存实力等待死灰复燃的再次感染机会以外,并不表现任何生命特征。因此,对通过抑制活跃致病菌的特定靶标功能实现杀菌或者抑菌的抗生素并不敏感。天然产物ADEPs通过激动ClpP蛋白酶的水解活性,非选择性降解细菌分裂蛋白FtsZ等,与利福平联用可以有效清除持留菌。这个特点赋予了化学小分子激动ClpP蛋白酶,清除持留菌的逻辑可行性。然而,激动ClpP水解功能的分子基础还有待深入探索。
上海药物所杨财广课题组前期合作研究描述了金黄色葡萄球菌ClpP蛋白酶的晶体结构以及分子动力学基础(J. Biol. Chem. 2013, 288, 17643-17653; J. Biol. Chem. 2011, 286, 37590-37601)。该研究成功设计并充分表征了具有功能获得性自激活的ClpP突变体ClpPN42AY63A,从分子机制和表型上,突变体的特征与ADEP紊乱激动ClpP水解酶的特征极其相似。首先研究表征了突变体蛋白质的生化活性、聚集状态及热稳定性,揭示Tyr63对于ClpP功能激动起到启动开关的作用。其次,解析了ClpPY63A突变体的晶体结构,发现具有多米诺效应的Asn42在功能激动中发挥促进增强的作用。
利用冷冻电镜技术展示ClpPY63AN42A的N端底物入口的口径变大,是实现功能激活的结构基础。利用扫描电镜实验确证了表达ClpPY63AN42A突变体的菌株生长缓慢是由于分裂蛋白FtsZ被降解,表现出金黄色葡萄球菌个体变大的表型,该结果也为评价ClpP小分子激动剂的表型研究提供实验模型。最后,由周虎课题组利用基于质谱的蛋白质组学技术,发现在表达ClpPY63AN42A的突变体菌株中有500多个蛋白质的丰度发生了显著性改变,尤其是FtsZ等蛋白质显著减少,与ADEP处理的野生菌株的蛋白质组分析结果一致。
该研究构建获得了具有非特异性自激活的ClpP突变水解体系,深入描述了ClpP功能激活的结构基础和分子机制,奠定了基于ClpP结构和功能发展小分子激动剂控制持留菌感染的基础。
该研究得到了浙江理工大学、上海光源、蛋白质设施、上海中医药大学、复旦大学以及上海药物所等合作课题组的大力支持,获得了国家自然科学基金、上海药物所自主部署项目等资助。研究成果于2016年5月在线发表于美国化学会化学生物学期刊ACS Chemical Biology上。
论文链接:http://pubs.acs.org/doi/abs/10.1021/acschembio.6b00390
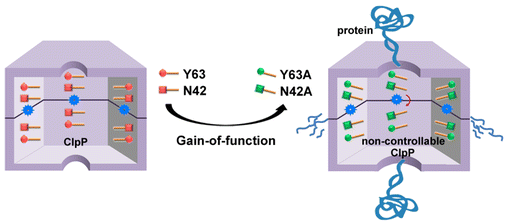
ClpP功能获得性突变体的作用示意图

