10月12日,复旦大学王文宁教授及其合作者在德国应用化学会刊物Angew Chem Int Ed Engl.发表题为“Conformational Dynamics of apo-GlnBP Revealed by Experimental and Computational Analysis.”的论文。
谷氨酰胺结合蛋白质GlnBP可以结合L型谷氨酰胺,并且与转运体协同配合完成谷氨酰胺的细胞摄入。晶体学研究表明GlnBP蛋白质存在“打开”和“关闭”两种结构。但是,构象变化动力学行为一直不清楚。该研究综合利用液体核磁、分子动力学模拟和单分子FRET等技术研究apo-GlnBP蛋白质的构象系综。核磁共振残余偶极耦合(RDCs)实验数据与分子动力学模拟的四个构象组成的系综模型相吻合,其中晶体结构之前发现的“打开”和“关闭”状态只是该系综的两种主要构象(如图所示)。其它两种构象状态的存在,证明了该蛋白质与配体相互作用的构象选择机制。
香港科技大学的黄旭辉教授和复旦大学的刘建伟教授是该文章的共同通讯作者,该研究得到了国家重点研发计划项目和国家基金委的经费支撑。蛋白质设施核磁系统技术主管刘志军博士,作为该文章的合作者,帮助用户在上海设施A800谱仪上完成了核磁RDCs实验,并协助分析数据。
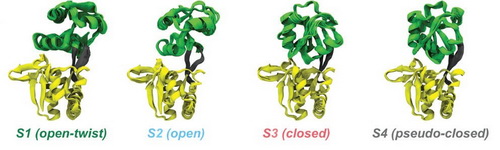
apo-GlnBP蛋白质的四态构象系综示意图,S2和S3对应晶体结构的两种主要构象。

