中国科学院生物与化学交叉研究中心(院设非法人研究单元,依托上海有机所等单位)刘聪课题组近年来一直致力于研究致病以及功能性amyloid的原子结构以及基于淀粉样蛋白原子结构的生物纳米材料设计。其在前期工作中,该团队发现并系统表征了阿尔兹海默病关键致病蛋白β淀粉样蛋白的聚集核心区形成的全新淀粉样纳米片层的独特结构(Proc. Natl. Acad. Sci. USA., 2015, 2996)。近期刘聪课题组与清华大学李雪明以及上海交通大学李丹课题组合作,发现FUS蛋白(渐动人症中关键致病蛋白)的amyloid具有高度可逆性和可调控性(包括磷酸化以及温度调控),表征了FUS蛋白amyloid的原子结构,证实高度可逆的amyloid在FUS蛋白的液态相分离中起到重要的作用。相关工作发表在《自然·结构与分子生物学》上(Nature Structural & Molecular Biology,2018, 25, 341–346. https://www.nature.com/articles/s41594-018-0050-8)。
本工作除了在阐释FUS形成可逆amyloid的机理和生物学意义以外,在蛋白质纳米级晶体的原子结构解析方法学上也有新的突破:发展出一整套基于低温冷冻电子显微镜的蛋白质电子衍射方法,并运用此方法解析出高达0.73埃的超高分辨率原子结构,此原子结构为目前运用电子显微镜解析出的最高分辨率的蛋白及多肽的原子结构,为推动电子衍射方法在蛋白质及多肽形成的超微晶原子结构解析中的应用奠定了基础。
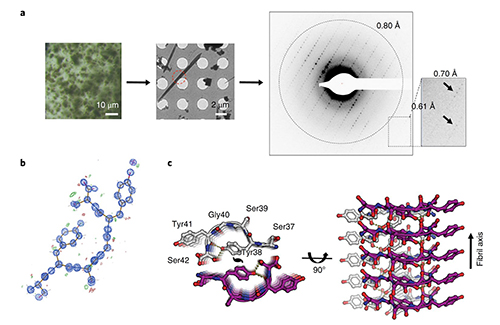
图一: FUS淀粉样核心聚集多肽的纳米级晶体电子衍射及原子结构解析
此外,由于近年在蛋白质淀粉样聚集结构与功能研究领域的积累,刘聪研究员受Cell杂志邀请与交大的李丹研究员共同撰写了题为“杂合淀粉样纤维结构揭示功能性淀粉样纤维介导细胞程序性坏死(Better together:A Hybrid amyloid signals necroptosis)”的专题评述(Cell, 2018 ,173, 1068-1070, https://www.cell.com/cell/fulltext/S0092-8674(18)30523-3), 系统介绍了近期发表的对于丝氨酸激酶RIPK1与苏氨酸激酶RIPK3形成异源amyloid在细胞坏死中行使功能的前沿成果。讨论了异源amyloid如何通过精细控制聚集核心区氨基酸的类型和空间排布来促使功能性异源amyloid的组装,并提出异源amyloid在细胞程序性坏死过程中如何被起始和调控的亟需解决的核心科学问题。
上述研究工作得到中国科学院、国家青年计划项目、科技部863计划青年科学家专题以及国家蛋白质重大专项的资助。

