2024年11月1日,《自然·通讯》期刊在线发表了题为《血管内输送用于记录皮层单细胞神经活动的超柔性神经电极阵列》的研究论文,该研究由中国科学院脑科学与智能技术卓越创新中心(神经科学研究所)赵郑拓研究组与复旦大学附属中山医院杨志刚医师团队合作完成。该研究通过神经介入手术方式,由颈部静脉入路,将一种超柔性可植入神经电极作为血管内装置到达窦汇处,穿过血管壁植入绵羊动物模型的视觉皮层,并在自发和视觉诱发条件下,记录了局部场电位(LFP)和多通道单细胞神经活动(AP)。此研究首次实现了大动物模型上免开颅微侵入式单细胞神经活动的记录,为未来的脑机接口和神经系统疾病的治疗提供全新的解决方案。
神经电极是建立高性能脑机接口 (BMI) 的关键。随着脑机接口技术的发展以及在运动功能修复等临床治疗中展现的突出优势,不同类型的电极,尤其是颅内电极的开发,对基础神经科学研究和临床应用都做出了重大贡献。
现有的部分神经电极,例如犹他阵列已广泛应用于 BMI 中的运动恢复,能够基于神经活动灵活地控制外部设备。Neuropixels 探针的超强采样能力彻底改变了我们研究和理解大脑功能的方式。然而,这些电极是由刚性材料(例如金属或硅基)制成,其长期植入后周围组织中会积累神经胶质疤痕,导致信号衰减或调控的不稳定。相比之下,超柔性微电极表现出了出色的生物相容性,能够形成更优的神经元-电极界面,可长期稳定地记录和调节大脑活动。然而,这些颅内电极需要开颅手术才能直接植入大脑,这会加剧生物组织的炎症反应风险,从而损害大脑功能。与此同时,介入方法由于无需开颅、恢复快住院时间短成为许多神经系统疾病治疗的首选方法。Stentrode作为一种血管内自膨镍钛合金支架式电极,已在绵羊上矢状窦(SSS)中实现了血管皮层电图(ECoG)记录和刺激,并进入临床试验阶段,用于重度瘫痪患者的运动神经假体,然而其信号精度的不足会使其应用受限。因此,现有开颅植入式BMI手术损伤大和介入式BMI信号精度低是目前BCI在临床转化中最需解决的痛点,
为了解决上述痛点,本研究提供了全新的介入式超柔性微电极皮层单细胞神经活动记录解决方案。赵郑拓研究组通过改进设计和工艺,制备出超长超柔性微电极,以满足电极从绵羊颈部入路经血管到达颅内视觉皮层的路径需求(图a)。同时,研究组与中山医院杨志刚医生团队合作探索了适用于超柔性微电极的术式方案的可行性,成功利用神经介入技术在绵羊静脉系统中将电极递送到目标大脑皮层(图b)。通过双方合作成功在术中采集到高信噪比、精细的单细胞神经活动(图c)。在此基础上,团队近一步评估了该全新植入策略的安全性。考虑到装置穿过血管壁期间可能出现的微出血,评估术后即刻的CT扫描结果中没有观察到脑组织内明显的出血迹象。同时术后第二天绵羊就表现出了独立直立行走的能力,表明血管内植入术式不会对大脑造成急性出血损伤。为了确认术式是否有任何长期影响,通过术后7天、30天的MRI扫描结果,观察到植入部位附近的脑组织表现出高度完整性,没有观察到组织损伤。进一步的,团队从柔性微电极在大鼠血管内3个月的埋植切片结果中,观察到电极被完整的薄层内皮组织所包覆,保证了长期使用下电极在血管内位置的固定和穿出位置的完整密封性。这些结果证明了该血管内植入策略的微创性与安全性。
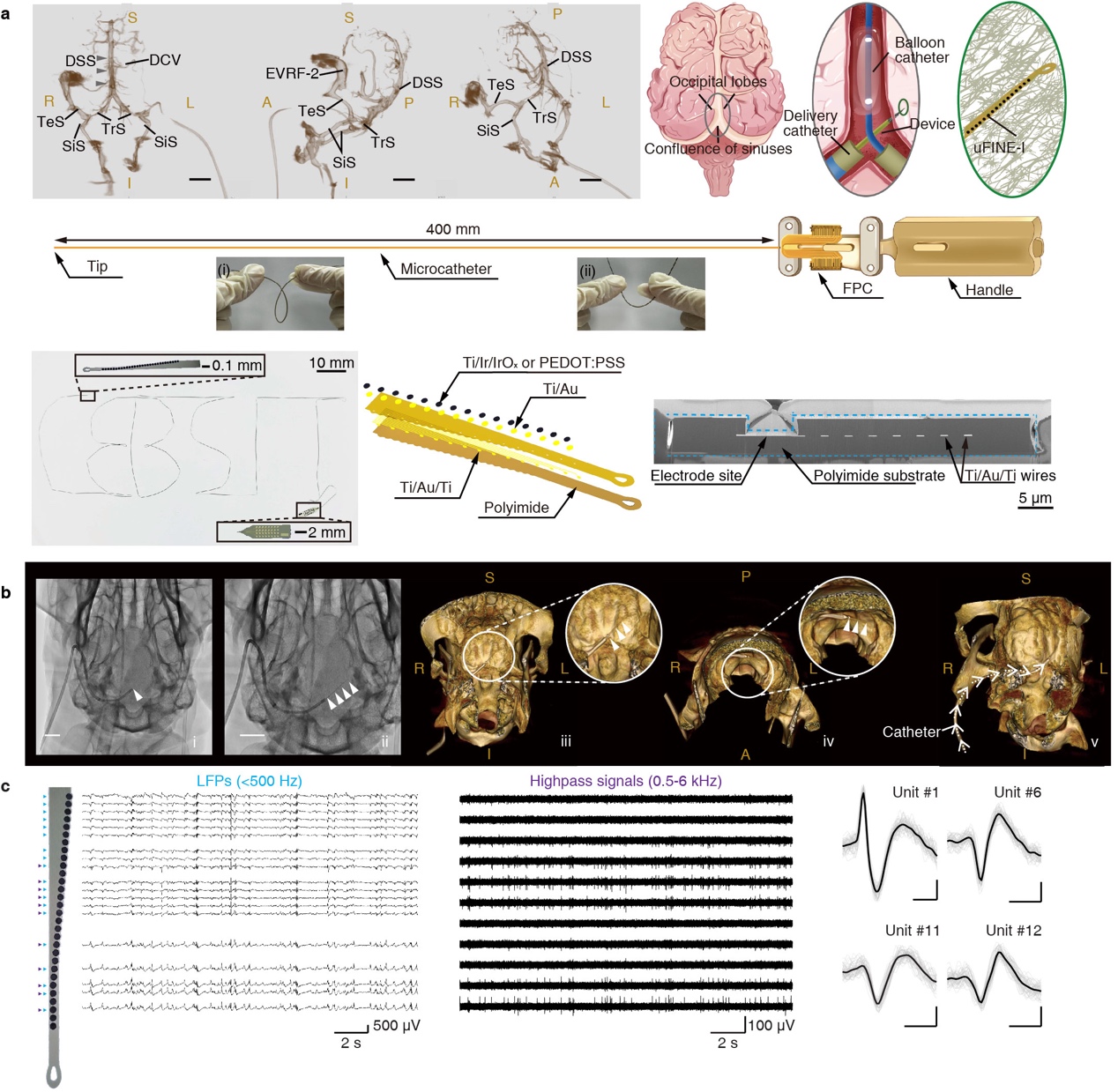
图注:(a)超柔性神经电极阵列及其植入示意图;(b)DSA术中植入影像及植入位置评估;(c)术中超柔性电极的神经信号记录
为了进一步探索该方案的临床转化潜力,团队通过人体颅内血管硅胶模型,模拟了装置推广到颅内静脉的分支(乙状窦-横窦-窦汇)和非分支(乙状窦-横窦-上矢状窦,乙状窦-横窦-上矢状窦-后额静脉,乙状窦-横窦-直窦-大脑内静脉)区域的可行性。由于运动皮层(靠近SSS的足部和靠近后额静脉的手部区域)和腹侧纹状体(靠近大脑内静脉)在瘫痪运动脑机接口和神经系统疾病调控领域具有重要的临床意义,本研究验证了装置将电极递送到这些区域的可行性。
此工作首次实现了通过血管内介入方式将超柔性电极植入脑组织的电极植入方法,避免传统开颅手术方式手术的较大损伤,弥补国际上现有的介入式植入方式信号精度低的不足,实现了微创多通道单细胞水平信号采集,为未来实现高质量神经信号交互,完成复杂外设控制与精细神经调控提供了全新的方案,兼顾植入微创性和获得信号高精度的特点,具有明显优势。
中国科学院脑科学与智能技术卓越创新中心(神经科学研究所)的博士后王兴昭为该研究的第一作者,赵郑拓研究员、杨志刚副主任医师以及任驰副研究员参与指导了该项工作,课题组的其他成员积极参与。

