6月10日,国际学术期刊Nucleic Acids Research发表了中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)惠静毅研究组的研究成果:“GPATCH4 functions as a regulator of nucleolar R-loops in hepatocellular carcinoma cells”。该研究发现了非经典RNA结合蛋白(RNA-binding proteins, RBP)GPATCH4编码基因在肝细胞癌(hepatocellular carcinoma, HCC)中发生高频扩增,并揭示了GPATCH4作为一个新鉴定到的R环(R-loop)调节蛋白促进肿瘤细胞RNA聚合酶I(Pol I)转录和细胞增殖的新机制。
在过去的十多年中,研究人员利用生物化学与质谱相结合的技术鉴定到大量新的RBPs,使人类基因组中具有RNA结合潜力的蛋白编码基因数目大约达到编码基因总数的10%以上。然而,对于大多数新鉴定的候选RBPs,尤其是那些不含有已知RNA结合结构域被称为非经典RBPs,我们仍不清楚它们通过结合RNA在各种生命过程中发挥何种功能与存在哪些作用机制。因此,深入探究它们的分子功能,很有可能可以从中发现与人类疾病密切相关的诊断或治疗的新靶点。
该研究首先通过多组学数据的整合分析系统地寻找了肝癌主要亚型HCC中发生改变的RBP候选基因,发现GPATCH4基因在超过70%的HCC患者中发生扩增,其高表达预示着不良预后。GPATCH4是携带G-patch蛋白结构域家族的一个成员,之前的研究提示了这类蛋白具有结合RNA的能力。通过使用iCLIP-seq技术,该研究绘制了GPATCH4在体内的RNA结合位点,发现GPATCH4主要与核糖体RNA(rRNA)结合,并利用生化方法证实GPATCH4是一个非经典RBP。进一步的研究发现GPATCH4通过增加rRNA转录和整体蛋白质合成,在体内和体外促进HCC细胞增殖和转化。在机制上,GPATCH4主要位于核仁,但它并不通过其G-patch蛋白结构域调控核仁的功能,而是通过其碳端固有无序区域(intrinsically disordered region, IDR)与RNA解旋酶DDX21相互作用,帮助解开rDNA上形成的R-loop。R-loop是一种三股核酸形成的染色质结构,可以广泛地调控基因转录与基因组稳定性。去除GPATCH4敲低后引起的R-loop积累,可挽救rRNA转录和细胞增殖的下降。综上所述,该研究鉴定到GPATCH4是一个在HCC中具有促癌作用的非经典RBP,揭示了其作为核仁R-loop调节器控制rRNA转录的新机制,并提示了Pol I抑制剂或针对GPATCH4的小分子抑制剂有可能可以治疗GPATCH4发生扩增的HCC患者。
分子细胞卓越中心博士研究生赵一鸣、博士后蒋琰和王金柱为该论文共同第一作者,惠静毅研究员为通讯作者。该项工作得到分子细胞卓越中心刘珈泉研究员和陈玲玲研究员及其实验室成员的大力帮助。该项工作获得中国科学院、科技部以及基金委的经费支持,并得到分子细胞卓越中心分子生物学技术平台和细胞分析技术平台的大力支持。
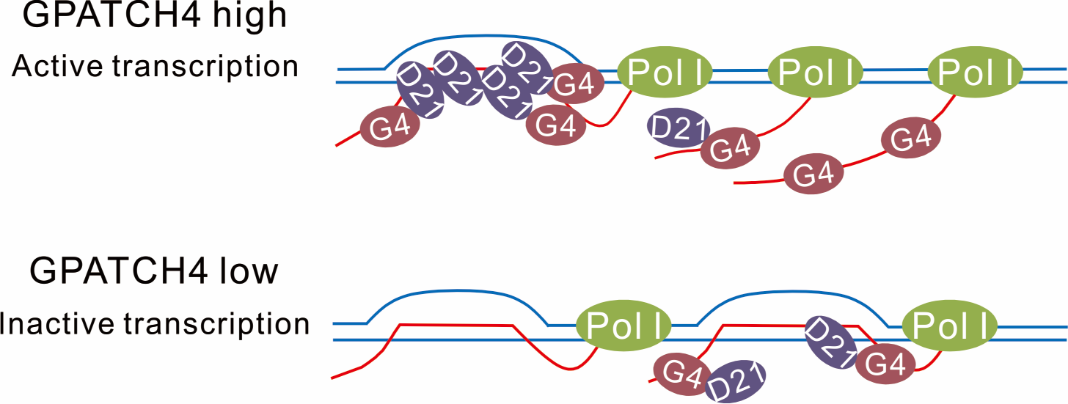
GPATCH4作为一个R-loop调节蛋白在HCC中调控rRNA转录的作用机制
文章链接:https://academic.oup.com/nar/article/53/10/gkaf438/8140458

